
| A. | 化学是以实验为基础的自然科学 | |
| B. | 化学是一门创造性的、实用性的科学 | |
| C. | 人类的化学实践活动起始于近代 | |
| D. | 现代化学,可称之为21世纪的中心科学 |
分析 化学是一门以化学实验为基础的自然科学,它具有实用性、创造性,可以说从人类学会使用火就开始了最早化学实践活动,现代化学是21世纪最有用、最富创造性的科学,基础进行解答.
解答 解:A.化学实验是化学的基础,是化学的主要组成部分,故A正确;
B.化学的应用非常广泛,实用性、创造性很强,故B正确;
C.化学的历史渊源非常古老,可以说从人类学会使用火就开始了最早化学实践活动,故C错误;
D.现代化学是21世纪最有用、最富创造性的科学,可称之为21世纪的中心科学,故D正确;
故选C.
点评 本题考查了化学的研究对象及应用价值,题目难度不大,明确化学的发展史、作用及研究对象为解答关键,试题侧重基础知识的考查,有利于提高学生学习化学的兴趣.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>X | B. | 氧化物的水化物的酸性:Y<Z | ||
| C. | 阴离子的还原性:W>Z | D. | X与Y不能存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用橡皮塞把液溴密封于玻璃瓶中 | |
| B. | 用磨口玻璃塞把氢氟酸密封于棕色试剂瓶中 | |
| C. | 把氯气加压液化后密封于钢瓶中 | |
| D. | 氯水通常保存于无色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数.
化学兴趣小组设定以下实验方案,测定某已变质为碳酸钠的小苏打样品中NaHCO3的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
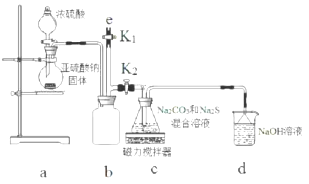
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O?H3O++B2- | |
| B. | 电解盐酸:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- | |
| D. | NaHCO3的电离:NaHCO3?Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
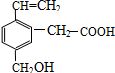 某有机物的结构为图所示,这种有机物具有的性质是( )
某有机物的结构为图所示,这种有机物具有的性质是( )| A. | ①②④ | B. | ①②③④ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大c(CH3COCH3) | B. | 增大c(I2) | C. | 升高温度 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com