

| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| 1 | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | a | $\frac{1}{3}$ | 5 |
| 3 | 350 | b | 5 |
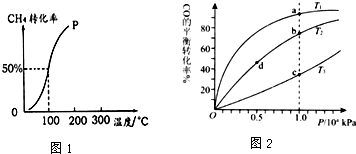
分析 (1)①根据图知道平衡时甲烷的转化率,求出△c(CH4),根据v=$\frac{△c}{△t}$计算v(CH4),利用速率之比等于化学计量数之比计算v(H2).
②根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;
平衡常数k=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$,计算出平衡时,各组分的浓度,代入平衡常数计算.
③由图可知,温度越高甲烷的转化率越大,即升高温度平衡向正反应方向移.
(2)①容器容积不变,增加甲醇产率,平衡向正反应移动,根据外界条件对平衡的影响分析.
②采取控制变量法,探究合成甲醇的温度和压强的适宜条件,据此判断a、b的值.
③根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时CO的转化率,由此判断.
解答 解:(1)①由图知道平衡时甲烷的转化率为0.5,所以△c(CH4)=$\frac{1.0mol×0.5}{100L}$=0.005mol/L,
所以v(CH4)=$\frac{0.005mol/L}{5min}$=0.001mol/(L•min),速率之比等于化学计量数之比,所以v(H2)=3v(CH4)=3×0.001mol/(L•min)=0.003mol/(L•min).
故答案为:0.003mol/(L•min).
②温度相同时,作垂直x轴的辅助线,发现压强为P1的CH4的转化率高,反应为前后体积增大的反应,压强增大平衡向体积减小的方向移动,即向逆反应移动,CH4的转化率降低,所以P1<P2.
CH4(g)+H2O(g)?CO(g)+3H2(g),
开始(mol):1.0 2.0 0 0
变化(mol):1.0×0.5 0.5 0.5 1.5
平衡(mol):0.5 1.5 0.5 1.5
所以平衡常数k=$\frac{c(CO){c}^{3}({H}_{2})}{c(C{H}_{4})c({H}_{2}O)}$=$\frac{\frac{0.5mol}{100L}×(\frac{1.5mol}{100L})^{3}}{\frac{0.5mol}{100L}×\frac{1.5mol}{100L}}$=2.25×10-4,
故答案为:<;2.25×10-4
③由图可知,温度越高甲烷的转化率越大,即升高温度平衡向正反应方向移,温度升高平衡向吸热方向移动,所以正反应为吸热反应,即△H>0.
故答案为:>
(2)①A、该反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应方向移动,甲醇的产率降低,故A错误;
B、将CH3OH(g)从体系中分离,产物的浓度降低,平衡向正反应移动,甲醇的产率增加,故B错误;
C、充入He,使体系总压强增大,容器容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D、再充入1mol CO和3mol H2,可等效为压强增大,平衡向体积减小的方向移动,即向正反应方向移动,甲醇的产率增加,故D正确.
故选:BD,
故答案为:BD;
②A、采取控制变量法,探究合成甲醇的温度和压强的适宜条件,所以温度、压强是变化的,$\frac{n(CO)}{n({H}_{2})}$应保持不变,所以b=$\frac{1}{3}$;比较使用1、2,压强不同,所以温度应相同,故a=150.
故答案为:a=150;b=$\frac{1}{3}$;
B、温度相同时,作垂直x轴的辅助线,发现压强为Py的CO的转化率高,反应为前后体积减小的反应,压强增大平衡向体积减小的方向移动,即向正反应移动,所以Px<Py,所以压强Px=0.1MPa.
故答案为:0.1
点评 本题考查化学反应速率、平衡常数、化学平衡计算、化学平衡的影响因素及读图能力等,综合性较大,难度中等,知识面广,应加强平时知识的积累.注意控制变量法与定一议二原则应用.


 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
0.1mol/L NH4Cl溶液中,下列叙述错误的是 ( )
A.c(NH4+)>c(Cl—)>c(OH—)>c(H+)
B.c(Cl—)>c(NH4+)>c(H+)>c(OH—)
C.c(NH4+)+c(H+)=c(Cl—)+c(OH—)
D.c(NH4+)+c(NH3 ·H2O)=c(Cl—)
·H2O)=c(Cl—)
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.加入铝粉能产生氢气的溶液:Mg2+、K+、Br-、HCO3-
B.滴入石蕊显红色的溶液:Na+、K+、S2-、NO3-
C.pH = 14的溶液中:Na+、AlO2-、SO42-、Cl-
D.滴入KSCN溶液显红色的溶液中:Ca2+、H+、I-、Cl-
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:填空题
查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4?(绿色)、Cr2O72?(橙红色)、CrO42?(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于_______________(选填编号)。
a.主族元素 b.副族元素 c.Ⅷ族元素 d.过渡元素
(2)铬单质是银白色有金属光泽的固体,有较高的熔点,是最硬的金属;与Ni等添加到Fe中可制成不锈钢。比较硬度:纯铁_________不锈钢;熔点:纯铁__________不锈钢(填“>”“<”或“=”)。
(3)Cr(OH)3与Al(OH)3的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是___________________。
(4)CrO42?和Cr2O72?在溶液中可相互转化。室温下,初始浓度为1.0 mol·L?1的Na2CrO4溶液中c(Cr2O72?)随c(H+)的变化如图所示。
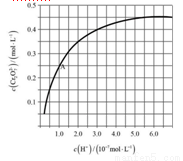
①用离子方程式表示Na2CrO4溶液中的转化反应____________________。
②由图可知,溶液酸性增大,CrO42?的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42?的平衡转化率减小,则该反应的ΔH__________0(填“>”“<”或“=”)。
(5)+6价铬的化合物毒性较大,但其化合物用途广泛。如:“酒精检测仪”可检查司机是否酒驾,其反应原理为:m C2H5OH+ n X + p H2SO4═ g Cr2(SO4)3 + w CO2↑+ 9H2O,其中X的化学式最有可能为__________。常用NaHSO3将酸性废液中的Cr2O72?还原成Cr3+,该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
材料、能源、信息、环境与化学关系密切,下列说法不正确的是
A.我们使用合金是因为它比纯金属具有更优良的机械性能
B.钢化玻璃、有机玻璃、石英玻璃均属于硅酸盐材料
C.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水
D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | KHSO4?K++H++SO42- | ||
| C. | Al(OH)3?Al3++3OH- | D. | HClO═H++ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com