
【题目】电解原理在工业生产中有广泛的应用。
(1)请写出电解熔融氯化钠的反应方程式______________________________。如图为离子交换膜法电解饱和食盐水的原理示意图,下列说法正确的是________。
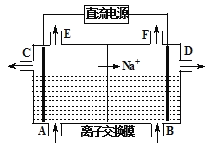
A.直流电源的左侧为负极
B.从E口逸出的气体是H2
C.从B口加入含少量NaOH的水溶液以增强导电性
D.从C口出来的溶液为NaOH溶液
E.每生成22.4 L Cl2,便产生2 mol NaOH
F.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液
G.该离子交换膜为阳离子交换膜
(2)双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为3H2O+3O2![]() O3+3H2O2。则阳极的电极反应式为__________________________,阴极的电极反应式____________________。
O3+3H2O2。则阳极的电极反应式为__________________________,阴极的电极反应式____________________。
(3)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。工业上用如下方法制备高铁酸钾:以Fe2O3为阳极电解KOH溶液,电解制高铁酸钾时阳极的电极反应式为______________________________。高铁酸钾长期放置会产生红色絮状物及气泡,则该过程的离子方程式_______________________。
【答案】2NaCl(熔融)![]() 2Na+Cl2↑ CG 3H2O-6e-=O3+6H+ O2+2e-+2H+=H2O2(或3O2+6e-+6H+=3H2O2) Fe2O3+10OH--6e-=2FeO42-+5H2O 4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑
2Na+Cl2↑ CG 3H2O-6e-=O3+6H+ O2+2e-+2H+=H2O2(或3O2+6e-+6H+=3H2O2) Fe2O3+10OH--6e-=2FeO42-+5H2O 4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑
【解析】
(1)根据电解池中的阳离子移向阴极,因此右边电极是阴极,氢离子得电子生成氢气,同时OH-离子剩余;氯离子在左侧阳极失电子生成氯气,所以直流电源的右侧为负极,左侧为正极,据此分析判断;
(2)根据3H2O+3O2![]() O3+3H2O2可知阳极发生氧化反应,阴极发生还原反应来书写;
O3+3H2O2可知阳极发生氧化反应,阴极发生还原反应来书写;
(3)Fe2O3作阳极制得的高铁酸钾,电极反应为:Fe2O3+10OH--6e-=2FeO42-+5H2O;
根据电子得失知氢氧化铁与氧气物质的量之比为4:3,书写离子方程式。
(1)电解熔融氯化钠生成钠和氯气,反应方程式为:2NaCl(熔融)![]() 2Na+Cl2↑;
2Na+Cl2↑;
电解池中的阳离子移向阴极,因此右边电极是阴极,生成氢气,OH-离子在右侧生成,氯气在左侧生成,直流电源的右侧为负极,故A、B错误,C正确,从D口出来的溶液为NaOH溶液,故D错误,由于没有给出氯气所处的外界条件,则不能根据其体积求算物质的量,故E错误,粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时氯化钡加在Na2CO3溶液之前,这样过量的氯化钡可被碳酸钠除去,故F错误,G正确;故正确的是CG,故答案为:2NaCl(熔融)![]() 2Na+Cl2↑;CG。
2Na+Cl2↑;CG。
(2)因为总反应为3H2O+3O2![]() O3+3H2O2,又阳极发生氧化反应,电极反应式为3H2O-6e-=O3+6H+,阴极发生还原反应,电极反应式为O2+2e-+2H+=H2O2(或3O2+6e-+6H+=3H2O2),故答案为:3H2O-6e-=O3+6H+,O2+2e-+2H+=H2O2(或3O2+6e-+6H+=3H2O2)。
O3+3H2O2,又阳极发生氧化反应,电极反应式为3H2O-6e-=O3+6H+,阴极发生还原反应,电极反应式为O2+2e-+2H+=H2O2(或3O2+6e-+6H+=3H2O2),故答案为:3H2O-6e-=O3+6H+,O2+2e-+2H+=H2O2(或3O2+6e-+6H+=3H2O2)。
(3)Fe2O3作阳极制得的高铁酸钾,电极反应为:Fe2O3+10OH--6e-=2FeO42-+5H2O;因为高铁酸钾溶液长时间放置不稳定,会产生红色絮状物质及气泡知生成氢氧化铁和氧气,由电子得失知二者的比为4:3,则反应的离子方程式是4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑,故答案为:Fe2O3+10OH--6e-=2FeO42-+5H2O,4FeO42-+10H2O=4Fe(OH)3↓+8OH-+3O2↑。


科目:高中化学 来源: 题型:
【题目】下列各组溶液中的两个反应,可用同一离子方程式表示的是
A. CaCO3和HCl、Na2CO3和HCl B. BaCl2和H2SO4、Ba(OH)2和H2SO4
C. HNO3和K2CO3、HCl和NaHCO3 D. KOH和H2SO4、Ba(OH)2和HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用下列几组试剂制取少量NH3:
①固体Ca(OH)2和NH4Cl;②浓氨水和固体CaO;③浓氨水。
请回答下列问题:
(1)用上述三组试剂制取少量NH3,需要加热的是________(填序号),第①组试剂中产生NH3的化学方程式可表示为____________________________________。
(2)下面的制取装置图中,方法①应选用装置________(填“A”或“B”,下同),方法②应选用装置________。

(3)在制取后,如果要干燥氨气,应选用的干燥剂是________(填字母)。
A.浓硫酸 B.固体氢氧化钠 C.五氧化二磷
D.碱石灰 E.固体CaO F.无水CaCl2
(4)检验集气瓶中是否收集满氨气的方法是__________________________________。
(5)为防止环境污染,如下装置(盛放的液体为水)可用于吸收多余NH3的是________(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.含有羟基的化合物一定属于醇类
B.代表醇类的官能团是与烃基或苯环侧链上的碳原子相连的羟基
C.酚类和醇类具有相同的官能团,因而具有相同的化学性质
D.分子内有苯环和羟基的化合物一定是酚类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物X、Y、A、B、C、D、E、F、G之间的转化关系如下所示。

已知以下信息:
①![]()
②![]() (R、R’代表烃基)
(R、R’代表烃基)
③X在催化剂作用下可与H2反应生成化合物Y。
④化合物F的核磁共振氢谱图中只有一个吸收峰。
回答下列问题:
(1)X的含氧官能团的名称是______,X与HCN反应生成A的反应类型是________。
(2)酯类化合物B的分子式是C15H14O3,其结构简式是________________。
(3)X发生银镜反应的化学方程式是______________________________________
(4)G在NaOH溶液中发生水解反应的化学方程式是_________________________
(5) 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式____________________________________________。
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为:2Li + nS=Li2Sn,有关该电池说法正确的是( )
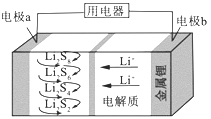
A. 放电时,Li+ 向负极迁移
B. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
C. 当外电路有2mol电子通过时,有1mol Li+通过阳离子交换膜
D. 该电池可以选用盐酸作为电解质增强溶液导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(标准状况下,22.4LHCl气体溶于50mL水再配成250mL溶液,求:
(1)所得盐酸的物质的量浓度为_____?
(2)若将此溶液再稀释成1L溶液,则稀释后盐酸的物质的量浓度变为的多少_____?;配制该浓度的溶液需要的玻璃仪器_____?
(3)将(2)的溶液取出250mL与足量Zn反应可以产生的H2在标准状况下的体积为_____?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:
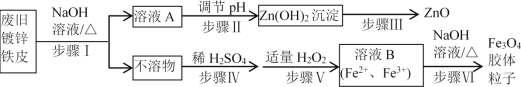
已知:Zn及化合物的性质与Al及化合物的性质相似。请回答下列问题:
(1)步骤Ⅰ用NaOH溶液处理废旧镀锌铁皮的作用有________。
A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化
(2)步骤Ⅲ的实验操作是______________________。
(3)写出步骤Ⅳ反应的化学方程式_______________。写出步骤Ⅴ反应的离子方程式__________。
(4)Fe3O4胶体粒子能否用过滤法实现固液分离?____(填“能”或“不能”),理由是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com