
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)晶体,设计了如下流程:

已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Al3+ | 3.3 | 5.0 |
(2)七水合硫酸亚铁(FeSO4·7H2O)的溶解度
温度/℃ | 10 | 20 | 30 | 40 | 50 |
FeSO4·7H2O溶解度(g) | 15.5 | 26.5 | 32.9 | 40.2 | 48.9 |
(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式_______________;检验溶液1中含有Fe3+的实验方法是___________________;
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式___________________;
(3)试剂X是__________________;固体2是___________________;
(4)加入NaOH溶液控制pH应不超过_________________;
(5)从溶液2中获得晶体的的方法为______________, _____________过滤、洗涤、干燥。
【答案】Fe2O3+ 6H+=2Fe3+ +3H2O取原溶液适量于洁净的小试管中,滴加KSCN溶液,若溶液显红色,则原溶液中含有Fe3+SiO2+C ![]() Si+COFeAl(OH)37.0高温溶解冷却结晶
Si+COFeAl(OH)37.0高温溶解冷却结晶
【解析】
烧渣的主要成分为Fe2O3、SiO2、Al2O3,烧渣中加入足量酸,其中Fe2O3、Al2O3转化为Fe3+、Al3+进入溶液1中,SiO2与酸不反应,固体1的成分为SiO2;根据流程,从溶液2中能获得FeSO4·7H2O,溶液2中溶质含FeSO4,则试剂X具有还原性,能将Fe3+还原为Fe2+,且不引进新杂质,则试剂X为Fe;根据各金属离子开始沉淀和沉淀完全时的pH,加入NaOH溶液控制pH使Al3+全部转化为Al(OH)3沉淀而除去、Fe2+不形成沉淀,控制的pH范围在5.0~7.0之间;FeSO4·7H2O受热易分解,FeSO4·7H2O的溶解度随着温度的升高明显增大,所以从溶液2中获得FeSO4·7H2O的操作为:蒸发浓缩、冷却结晶,过滤、洗涤、干燥;据此作答。
烧渣的主要成分为Fe2O3、SiO2、Al2O3,烧渣中加入足量酸,其中Fe2O3、Al2O3转化为Fe3+、Al3+进入溶液1中,SiO2与酸不反应,固体1的成分为SiO2;根据流程,从溶液2中能获得FeSO4·7H2O,溶液2中溶质含FeSO4,则试剂X具有还原性,能将Fe3+还原为Fe2+,且不引进新杂质,则试剂X为Fe;根据各金属离子开始沉淀和沉淀完全时的pH,加入NaOH溶液控制pH使Al3+全部转化为Al(OH)3沉淀而除去、Fe2+不形成沉淀,控制的pH范围在5.0~7.0之间。
(1)Fe2O3与硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,离子方程式为Fe2O3+6H+=2Fe3++3H2O。检验Fe3+用KSCN溶液,检验溶液1中含Fe3+的实验方法是:取溶液1适量于洁净的小试管中,滴加KSCN溶液,若溶液显红色,则溶液1中含有Fe3+。
(2)固体1的成分为SiO2,SiO2制作Si的化学方程式为SiO2+2C![]() Si+2CO↑。
Si+2CO↑。
(3)试剂X的作用是将Fe3+还原为Fe2+,且不引进新杂质,试剂X为Fe,加入Fe发生的主要反应的离子方程式为Fe+2Fe3+=3Fe2+。根据各金属离子开始沉淀和沉淀完全时的pH,加入NaOH溶液控制pH使Al3+全部转化为Al(OH)3沉淀而除去、Fe2+不形成沉淀,固体2是Al(OH)3。
(4)根据各金属离子开始沉淀和沉淀完全时的pH,加入NaOH溶液控制pH使Al3+全部转化为Al(OH)3沉淀而除去、Fe2+不形成沉淀,控制pH应不超过7.0。
(5)由于FeSO4·7H2O受热易分解,FeSO4·7H2O的溶解度随着温度的升高明显增大,所以从溶液2中获得FeSO4·7H2O的操作为:蒸发浓缩、冷却结晶,过滤、洗涤、干燥。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】在一密闭容器中,等物质的量的A和B发生反应:A(g)+2B(g) ![]() 2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
A. 40% B. 50% C. 60% D. 70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol O3和3 mol O2的质量之比________,分子数之比________,同温同压的密度之比为________,含氧原子数之比为________,体积之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) ![]() CH3COOC2H5(g)+2H2(g),在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是
CH3COOC2H5(g)+2H2(g),在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测不合理的是
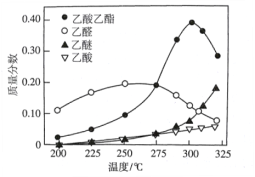
A. 反应温度不宜超过300℃
B. 该反应属于消去反应
C. 在催化剂作用下,乙醛是反应历程中的中间产物
D. 提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式: 。
(2)在海洋循环中,通过下图所示的途径固碳。

①写出钙化作用的离子方程式: 。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整: + ===(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的还说中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。

②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度= mol/L。
(4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

①结合方程式简述提取CO2的原理: 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+、B2+、C-、D2-4种离子具有相同的电子层结构。现有以下排列顺序:
①B2+>A+>C->D2-②C->D2->A+>B2+③B2+>A+>D2->C-④D2->C->A+>B2+4种离子的半径由大到小以及4种元素原子序数由大到小的顺序分别是( )
A.①④B.④①C.②③D.③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有浓度均为3mol·L-1的盐酸和硫酸各100mL,分别加入等质量的Fe粉,反应完毕后生成气体的质量之比为3:4,则加入盐酸中的铁粉的质量为
A. 5.6g B. 8.4g C. 11.2g D. 16.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. FeCl3+3KSCN![]() Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
Fe(SCN)3+3KCl平衡体系中加入少量KSCN固体,溶液颜色加深
B. 工业合成氨中,将氨气液化分离
C. A、B两支试管中分别加入等体积5%的H2O2溶液,在B试管中加入2~3滴FeCl3溶液,B中试管中产生气泡快
D. 对于反应2NO2(g)![]() N2O4(g) △H<0,升高温度可使体系颜色变深
N2O4(g) △H<0,升高温度可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般情况下,前者无法决定后者的是
A.原子核外电子排布﹣﹣元素在周期表中的位置
B.硝酸具有强氧化性﹣﹣铜单质易溶于浓硝酸
C.分子间作用力的大小﹣﹣分子稳定性的高低
D.二氧化硫具有还原性﹣﹣二氧化硫能使高锰酸钾溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com