
化学在工业生产和日常生活中有着重要的应用.下列说法正确的是( )
|
| A. | CO2、NO2和SiO2都是酸性氧化物,都是大气污染物 |
|
| B. | Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
|
| C. | 常温下,浓硫酸、浓硝酸与铁均能发生钝化,均能用铁罐储运 |
|
| D. | NaClO和明矾都能作消毒剂或净水剂,加入酚酞试液均显红色 |
考点:
常见的生活环境的污染及治理;盐类水解的应用;硝酸的化学性质;氮的氧化物的性质及其对环境的影响;浓硫酸的性质;硅和二氧化硅.
专题:
元素及其化合物.
分析:
A、酸性氧化物是能和碱反应生成盐和水的化合物,二氧化碳是无毒物质;
B、根据Na2O2、H2O2所含的化学键类型以及化学性质来回答;
C、常温下,冷的浓硫酸、浓硝酸均能使Al、Fe钝化;
D、明矾中的Al3+水解显酸性,氢氧化铝具有净水作用,次氯酸盐具有氧化性.
解答:
解:A、NO2不是酸性氧化物,二氧化碳不是大气污染物,故A错误;
B、Na2O2中含有离子键和共价键,H2O2中只含共价键,含有的化学键不一样,故B错误;
C、冷的浓硫酸、浓硝酸均能使Al、Fe钝化,故在常温条件下,能用铁罐储运浓硫酸、浓硝酸,故C正确;
D、明矾中的Al3+水解显酸性,加入酚酞试液不变色,故D错误.
故选C.
点评:
本题考查学生物质的性质和应用等方面的知识,注意知识的归纳和整理是解题关键,难度不大.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
反应N2(g)+3H2(g) 2NH3(g) ΔH<0,在某一时间段中反应速率与反应过程的曲线关系如下图,则氨的百分含量最高的一段时间是( )
2NH3(g) ΔH<0,在某一时间段中反应速率与反应过程的曲线关系如下图,则氨的百分含量最高的一段时间是( )
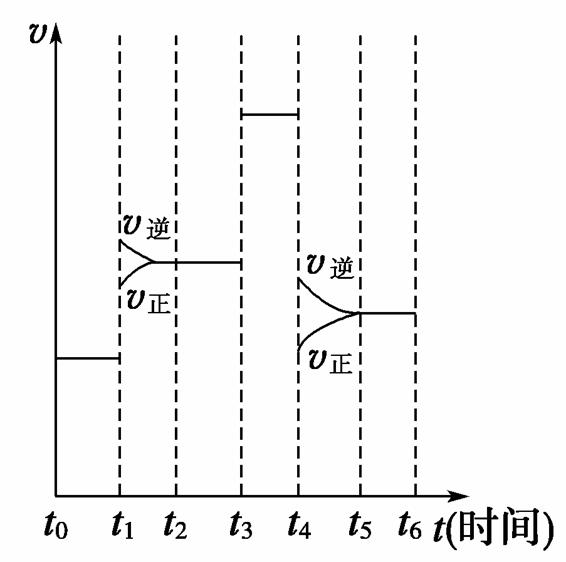
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
查看答案和解析>>
科目:高中化学 来源: 题型:
100mL某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,会产生H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则(1)溶液中一定含有的阳离子有 H ,一定不含有的离子有 .
(2)C→D的离子方程式为 .
(3)由A→B及C→D段有关数据可计算出的某两种离子的物质的量浓度分别为 mol•L﹣1和 mol•L﹣1.

查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.22.4L的N2和CO所含分子数均为NA
B.1.7g NH3中含有的电子数为NA
C.标准状况下,11.2L H2O含有的分子数为0.5NA
D.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列物质能导电是 ,属于电解质的是 ,
属于非电解质的是 .(填写序号)
①水银 ②烧碱 ③大理石 ④氯化钠晶体 ⑤盐酸溶液 ⑥蔗糖 ⑦CO2
(2)按要求写出下列方程式:
①硫酸铝电离的电离方程式:
②碳酸钙与盐酸反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应所得溶液中一定只含一种溶质的是( )
|
| A. | 向铁粉中加入稀硝酸 |
|
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 |
|
| C. | 向MgSO4、H2SO4的混合液中滴入过量的Ba(OH)2溶液 |
|
| D. | 向NaOH溶液中通入CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol•L﹣1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
|
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | P4和CO2分子中都只含有共价键 |
|
| B. | CCl4和NH3的分子的立体结构都是正四面体形 |
|
| C. | BF3分子中各原子均达到8e﹣稳定结构 |
|
| D. | 甲烷的结构式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景.
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)⇌CH3OH(g)△H1=﹣90kJ•mol﹣1
②CO(g)+H2O(g)⇌CO2(g)+H2(g)△H2=﹣41kJ•mol﹣1
写出由二氧化碳、氢气制备甲醇的热化学方程式: .
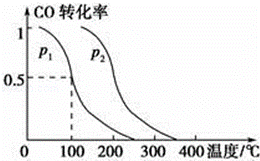
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示.
①p1 小于p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率(填“增大”、“减小”或“不变”,下同),平衡常数 .
(3)已知在T℃时,CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol•L﹣1,c始(H2O)=1mol•L﹣1,某时刻经测定CO的转化率为10%,则该反应没有(填“已经”或“没有”)达到平衡,原因是Qc K,此时刻v正 v逆(填“>”或“<”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com