
【题目】某校学习小组的同学设计了如下图所示装置验证SO2的某些性质。下列说法正确的是

A. Ⅰ中浓硫酸表现强氧化性
B. Ⅱ中紫色石蕊溶液先变红后褪色
C. Ⅲ中硫化氢溶液用于验证SO2的氧化性
D. Ⅲ中两个棉球均褪色,加热后均又恢复原来颜色
科目:高中化学 来源: 题型:
【题目】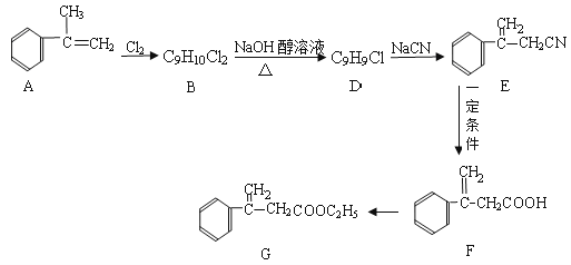
(1)F的官能团名称____________;
(2)B→D的化学反应方程式为______;
(3)D→E的化学反应类型为___________;
(4)F转化为G的化学反应方程式为_______;
(5)H是F的同分异构体,它是苯的邻位二取代物,遇FeCl3溶液显示特征颜色,则H可能的结构简式为(任写一种)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1molN2O4充入容积固定为2 L的密闭容器中,发生反应:N2O4![]() 2NO2(g)。经2s达到化学平衡状态,此时测得容器中c(NO2)=0.2mol/L。
2NO2(g)。经2s达到化学平衡状态,此时测得容器中c(NO2)=0.2mol/L。
(1)下列说法中,一定能说明该反应达到平衡状态的是_________(填序号)。
A.正、逆反应均已停止 B. v(NO2)=2v(N2O4)
C.容器中 c(NO2) : c(N2O4)=2∶1 D.混合气体的密度不变
E.混合气体的压强不变 F.混合气体的颜色不变
(2)0~2 s内反应的平均速率v(NO2)=___________________。
(3)达到平衡时容器中c(N2O4)=______________________。
(4)达到平衡时,N2O4转化率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.7%,则能在碱性溶液中发生反应的X的同分异构体有(不考虑立体异构)( )
A. 12种B. 13种C. 14种D. 15种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某学习小组模拟化工生产设计了如下流程制备精铜。

已知:Cu2O + 2 H+ = Cu + Cu2+ + H2 O
回答下列问题:
(1)实际生产中,常将铜矿石粉碎的目的是______________________________。
(2)滤渣1中含有较多的铜,提纯滤渣1时反应的离子方程式为_______________________________。
(3)滤液1中铁元素的存在形式为______________(填离子符号),检验该离子的常用试剂为________________。
(4)写出加入铝粉时生成铜的化学方程式:______________________________。
(5)“电解”精炼过程中,粗铜与外接电源的___________极相连;阴极的电极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛矿的酸性废液(含TiO2+、Fe2+、Fe3+、SO42-等),可回收获得FeS2纳米材料、Fe2O3和TiO2·nH2O等产品,流程如下:
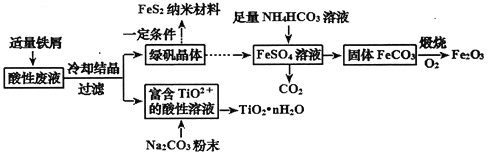
(1)TiO2+中钛元素的化合价为________价。TiO2+只能存在于强酸性溶液中,因为TiO2+易水解生成TiO2·nH2O,写出水解的离子方程式_________________________________。
(2)向富含TiO2+的酸性溶液中加入Na2CO3粉末能得到固体TiO2·nH2O。请用化学反应原理解释__________________________________。
(3)NH4HCO3溶液与FeSO4溶液反应的离子方程式为_______________________,该反应需控制温度在308K以下,其目的是_____________________________。
(4)已知298K时,Ksp[Fe(OH)2]=8.0×10-16,若在生成的FeCO3达到沉淀溶解平衡时,测得溶液的pH为8.5,c(Fe2+)=1.0×10-5mol·L-1,则所得的FeCO3中________Fe(OH)2(填“有”或“没有”)。
(5)FeS2纳米材料可用于制造高容量锂电池,已知电解质为熔融的K2S,电池放电时的总反应为:4Li+FeS2=Fe+2Li2S,则正极的电极反应式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙三种物质均含有同种元素X,其转化关系如下:
![]()
下列说法错误的是
A.若A为NaOH溶液,乙为白色沉淀,则X可能为短周期金属元素
B.若A为硝酸,X为金属元素,则甲与乙反应可生成丙
C.若A为氧气,丙在通常状况下为红棕色气体,则甲可能为非金属单质
D.若乙为NaHCO3,则甲或丙可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-硝基-1,3-苯二酚由间苯二酚先磺化,再硝化,后去磺酸基生成。原理如下:
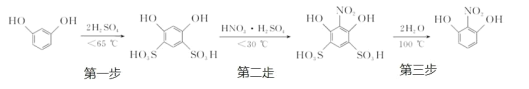
部分物质的相关性质如下:
名称 | 性状 | 熔点/℃ | 水溶性(常温) |
间苯二酚 | 白色针状晶体 | 110.7 | 易溶 |
2-硝基-1,3-苯二酚 | 桔红色针状晶体 | 87.8 | 难溶 |
制备过程如下:
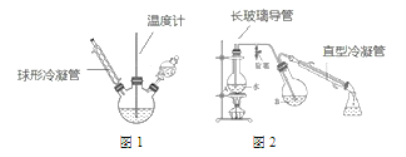
第一步:磺化。称取一定质量的间苯二酚,碾成粉末放入烧瓶中,慢慢加入适量浓硫酸并不断搅拌,控制温度在一定范围内反应 15 min(如图 1)。
第二步:硝化。待磺化反应结束后将烧瓶置于冷水中,充分冷却后加入“混酸”,控制温度继续搅15 min。第三步:蒸馏。将硝化反应混合物的稀释液转移到圆底烧瓶 B 中,然后用图 2 所示装置进行水蒸气蒸馏,收集馏出物,得到 2-硝基-1,3-苯二酚粗品。
请回答下列问题:
(1)磺化步骤中控制温度最合适的范围为(填字母)________。
a.30 ℃~60 ℃ b.60 ℃~65 ℃ c.65 ℃~70 ℃ d.70 ℃~100 ℃
(2)酚羟基邻对位的氢原子比较活泼,均易被取代,请分析第一步磺化引入磺酸基基团(-SO3H)的作用是_______________________。
(3)硝化步骤中制取“混酸”的具体操作是______________________。
(4)下列说法正确的是_______________。
a 直型冷凝管内壁中可能会有红色晶体析出
b 图 2 中的冷凝管能用图 1 中的冷凝管代替
c 烧瓶A中长玻璃管起稳压作用,既能防止装置中压强过大引起事故,又能防止压强过小引起倒吸。
(5)蒸馏步骤中,水蒸气蒸馏的作用是__________________。可通过________(填操作)进一步提纯 2-硝基-1,3-苯二酚。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com