
ŅŃÖŖA(g)+B(g) C(g)+D(g)·“Ó¦µÄĘ½ŗā³£ŹżŗĶĪĀ¶ČµÄ¹ŲĻµČēĻĀ£ŗ
C(g)+D(g)·“Ó¦µÄĘ½ŗā³£ŹżŗĶĪĀ¶ČµÄ¹ŲĻµČēĻĀ£ŗ
| ĪĀ¶Č/ ”ę | 700 | 800 | 830 | 1000 | 1200 |
| Ę½ŗā³£Źż | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)µÄĘ½ŗā³£ŹżµÄÖµĪŖ ”£
A(g)+B(g)µÄĘ½ŗā³£ŹżµÄÖµĪŖ ”£ 19£®£Ø12·Ö£©£Ø1£©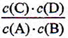 < £Øø÷2·Ö£©£Ø2£©0.022 mol”¤L-1 0.09mol 80% 80%£Øø÷1·Ö£©£Ø3£©c£Ø2·Ö£©£Ø4£©2.5£Ø2·Ö£©
< £Øø÷2·Ö£©£Ø2£©0.022 mol”¤L-1 0.09mol 80% 80%£Øø÷1·Ö£©£Ø3£©c£Ø2·Ö£©£Ø4£©2.5£Ø2·Ö£©
½āĪöŹŌĢā·ÖĪö£ŗ£Ø1£©æÉÄę·“Ó¦A£Øg£©+B£Øg£©?C£Øg£©+D£Øg£©µÄĘ½ŗā³£Źż±ķ“ļŹ½k= £¬
£¬
ÓɱķÖŠŹż¾ŻæÉÖŖ£¬ĪĀ¶ČŌ½øßĘ½ŗā³£ŹżŌ½Š”£¬ĖµĆ÷ÉżøßĪĀ¶ČĘ½ŗāĻņÄę·“Ó¦ŅĘ¶Æ£¬¹ŹÕż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬¼“”÷H£¼0£¬£Ø2£©·“Ó¦³õŹ¼6sÄŚAµÄĘ½¾ł·“Ó¦ĖŁĀŹv£ØA£©=0.003mol?L-1?s-1£¬Ōņ6sÄŚ”÷c£ØA£©=0.003mol?L-1?s-1”Į6s=0.018mol/L£¬AµÄĘšŹ¼ÅضČĪŖ=0.04mol/L£¬¹Ź6sŹ±Ź±c£ØA£©=0.04mol/L-0.018mol/L=0.022mol/L£¬¹Ź6sÄŚ”÷n£ØA£©=0.018mol/L”Į5L=0.09mol£¬ÓÉ·½³ĢŹ½æÉÖŖn£ØC£©=”÷n£ØA£©=0.09mol£¬
ÉčĘ½ŗāŹ±AµÄÅØ¶Č±ä»ÆĮæĪŖx£¬Ōņ
A£Øg£©+B£Øg£©?C£Øg£©+D£Øg£©
æŖŹ¼£Ømol/L£©£ŗ0.04 0.16 0 0
±ä»Æ£Ømol/L£©£ŗx x x x
Ę½ŗā£Ømol/L£©£ŗ0.04-x 0.16-x x x
¹Ź =1£¬½āµĆx=0.032ĖłŅŌĘ½ŗāŹ±AµÄ×Ŗ»ÆĀŹĪŖ
=1£¬½āµĆx=0.032ĖłŅŌĘ½ŗāŹ±AµÄ×Ŗ»ÆĀŹĪŖ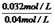 ”Į100%=80%£¬Ģå»ż²»±ä£¬³äČė1molė²Ęų£¬·“Ó¦»ģŗĻĪļø÷×é·ÖµÄÅØ¶Č²»±ä£¬±ä»Æ²»ŅĘ¶Æ£¬AµÄ×Ŗ»ÆĀŹ²»±äĪŖ80%.£Ø3£©a£®øĆ·“Ó¦Ē°ŗóĘųĢåµÄĪļÖŹµÄĮæ²»±ä£¬Ń¹ĒæŹ¼ÖÕ²»±ä£¬¹ŹŃ¹Ēæ²»Ėꏱ¼äøı䣬²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹Źa“ķĪó£¬b£®»ģŗĻĘųĢåµÄ×ÜÖŹĮæ²»±ä£¬ČŻĘ÷µÄČŻ»ż²»±ä£¬¹Ź»ģŗĻĘųĢåµÄĆܶȏ¼ÖÕ²»±ä£¬¹ŹĘųĢåµÄĆÜ¶Č²»Ėꏱ¼äøı䣬²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹Źb“ķĪó£¬c£®æÉÄę·“Ó¦µ½“ļĘ½ŗāŹ±£¬ø÷×é·ÖµÄÅØ¶Č²»·¢Éś±ä»Æ£¬¹Źc£ØA£©²»Ėꏱ¼äøı䣬ĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹcÕżČ·£¬d£®µ„Ī»Ź±¼äĄļÉś³ÉCŗĶDµÄĪļÖŹµÄĮæĻąµČ£¬¶¼±ķŹ¾Õż·“Ó¦ĖŁĀŹ£¬·“Ó¦Ź¼ÖÕ°“1£ŗ1Éś³ÉC”¢DµÄĪļÖŹµÄĮ棬²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹Źd“ķĪ󔣣Ø4£©Ķ¬Ņ»·“Ó¦ŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬Õż”¢Äę·“Ó¦·½ĻņµÄĘ½ŗā³£Źż»„ĪŖµ¹Źż£¬¹Ź1200”ꏱ·“Ó¦C£Øg£©+D£Øg£©?A£Øg£©+B£Øg£©µÄĘ½ŗā³£ŹżµÄÖµĪŖ
”Į100%=80%£¬Ģå»ż²»±ä£¬³äČė1molė²Ęų£¬·“Ó¦»ģŗĻĪļø÷×é·ÖµÄÅØ¶Č²»±ä£¬±ä»Æ²»ŅĘ¶Æ£¬AµÄ×Ŗ»ÆĀŹ²»±äĪŖ80%.£Ø3£©a£®øĆ·“Ó¦Ē°ŗóĘųĢåµÄĪļÖŹµÄĮæ²»±ä£¬Ń¹ĒæŹ¼ÖÕ²»±ä£¬¹ŹŃ¹Ēæ²»Ėꏱ¼äøı䣬²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹Źa“ķĪó£¬b£®»ģŗĻĘųĢåµÄ×ÜÖŹĮæ²»±ä£¬ČŻĘ÷µÄČŻ»ż²»±ä£¬¹Ź»ģŗĻĘųĢåµÄĆܶȏ¼ÖÕ²»±ä£¬¹ŹĘųĢåµÄĆÜ¶Č²»Ėꏱ¼äøı䣬²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹Źb“ķĪó£¬c£®æÉÄę·“Ó¦µ½“ļĘ½ŗāŹ±£¬ø÷×é·ÖµÄÅØ¶Č²»·¢Éś±ä»Æ£¬¹Źc£ØA£©²»Ėꏱ¼äøı䣬ĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹcÕżČ·£¬d£®µ„Ī»Ź±¼äĄļÉś³ÉCŗĶDµÄĪļÖŹµÄĮæĻąµČ£¬¶¼±ķŹ¾Õż·“Ó¦ĖŁĀŹ£¬·“Ó¦Ź¼ÖÕ°“1£ŗ1Éś³ÉC”¢DµÄĪļÖŹµÄĮ棬²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹Źd“ķĪ󔣣Ø4£©Ķ¬Ņ»·“Ó¦ŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬Õż”¢Äę·“Ó¦·½ĻņµÄĘ½ŗā³£Źż»„ĪŖµ¹Źż£¬¹Ź1200”ꏱ·“Ó¦C£Øg£©+D£Øg£©?A£Øg£©+B£Øg£©µÄĘ½ŗā³£ŹżµÄÖµĪŖ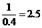
æ¼µć£ŗ»ÆŃ§Ę½ŗāדĢ¬µÄÅŠ¶Ļ£»»ÆŃ§Ę½ŗāµÄÓ°ĻģŅņĖŲ£»»ÆŃ§Ę½ŗāµÄµ÷æŲ×÷ÓĆ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ĻÖÓŠæÉÄę·“Ó¦£ŗmA(g)+nB(g)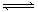 pC(g)+ qD(g)£»øł¾ŻĻĀĶ¼Ź¾»Ų“š£ŗ
pC(g)+ qD(g)£»øł¾ŻĻĀĶ¼Ź¾»Ų“š£ŗ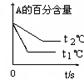
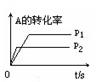
£Ø1£©×óĶ¼ÖŠĪĀ¶Čt1”ę t2”ę£ØĢī”°øßÓŚ”±»ņ”°µĶÓŚ”±£©
£Ø2£©øĆ·“Ó¦µÄÕż·“Ó¦ĪŖ ·“Ó¦£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©
£Ø3£©ÓŅĶ¼ÖŠŃ¹Ēæ p1 p2£ØĢī”°£¾”±”¢”°£¼”±”¢”°=”±£©
£Ø4£©·“Ó¦Ź½ÖŠ£Øm +n£© £Øp +q£©£ØĢī”°£¾”±”¢”°£¼”±”¢”°=”±£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
Ģś¼°Ęä»ÆŗĻĪļŌŚÉś²ś”¢Éś»īÖŠÓ¦ÓĆ¹ć·ŗ”£
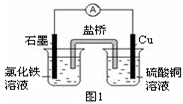
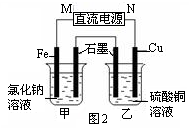
£Ø1£©Ņ»¶ØĢõ¼žĻĀ£¬FeÓėCO2æÉ·¢Éś·“Ó¦£ŗ
2Fe(s)+3CO2(g) Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
øĆ·“Ó¦µÄĘ½ŗā³£Źż(K ) ĖęĪĀ¶Č(T ) Éżø߶ųŌö“ó”£
¢ŁøĆ·“Ó¦µÄĘ½ŗā³£ŹżK=______”££ØĢī±ķ“ļŹ½£©
¢ŚĻĀĮŠ“ėŹ©ÖŠ£¬ÄÜŹ¹Ę½ŗāŹ±c(CO)£Æc(CO2) Ōö“óµÄŹĒ (Ģī±źŗÅ)”£
| A£®ÉżøßĪĀ¶Č | B£®Ōö“óŃ¹Ēæ |
| C£®³äČėŅ»¶ØĮæCO | D£®ŌŁ¼ÓŅ»Š©Ģś·Ū |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
¼×“¼ŹĒÖŲŅŖµÄ»Æ¹¤ŌĮĻŗĶĒå½ąŅŗĢåČ¼ĮĻ”£¹¤ŅµÉĻæÉĄūÓĆCO»ņCO2Ą“Éś²ś¼×“¼”£¼×“¼ÖĘ
±øµÄĻą¹ŲŠÅĻ¢ČēĻĀ±ķ£ŗ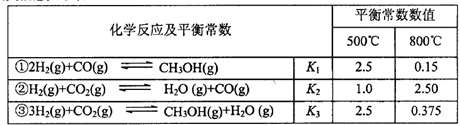
£Ø1£©·“Ó¦¢ŚŹĒ____·“Ó¦£ØŃ”Ģī”°ĪüČČ”±”°·ÅČČ”±£©”£
£Ø2£©¾ŻÉĻ±ķŠÅĻ¢Ķʵ¼³ö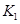 ”¢
”¢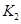 Óė
Óė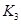 Ö®¼äµÄ¹ŲĻµ£¬
Ö®¼äµÄ¹ŲĻµ£¬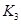 =______ÓĆ
=______ÓĆ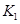 ”¢
”¢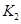 ±ķŹ¾£©”£500”ꏱ²āµĆ·“Ó¦¢ŪŌŚÄ³Ź±æĢ£¬
±ķŹ¾£©”£500”ꏱ²āµĆ·“Ó¦¢ŪŌŚÄ³Ź±æĢ£¬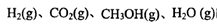 µÄÅضČ(mol/L)·Ö±šĪŖ0 8”¢0.1”¢0 3”¢0 15£¬“ĖŹ±
µÄÅضČ(mol/L)·Ö±šĪŖ0 8”¢0.1”¢0 3”¢0 15£¬“ĖŹ± £ØŃ”Ģī”°>”±”°<”±”°=”±£©”£
£ØŃ”Ģī”°>”±”°<”±”°=”±£©”£
£Ø3)ČōijĪĀ¶ČĻĀ·“Ó¦¢Ł“ÓæŖŹ¼µ½Ę½ŗāCOŗĶCH3OHµÄÅØ¶Č±ä»ÆČēĶ¼Ņ»ĖłŹ¾£¬ŌņÓĆH2ÅØ¶Č±ä»Æ±ķŹ¾“Ė¶ĪŹ±¼äÄŚøĆ·“Ó¦µÄĘ½¾łĖŁ.v(H2)= ČōijĪĀ¶ČĻĀ·“Ó¦¢ŁÖŠH2µÄĘ½ŗā×Ŗ»ÆĀŹ(a)ÓėĢåĻµ×ÜŃ¹Ēæ(P)µÄ¹ŲĻµČēĶ¼¶žĖłŹ¾£¬ŌņĘ½ŗāדĢ¬ÓÉA±äµ½BŹ±£¬Ę½ŗā³£Źż £ØŃ”Ģī”°>”±”°<”±”°=”±£©”£
£ØŃ”Ģī”°>”±”°<”±”°=”±£©”£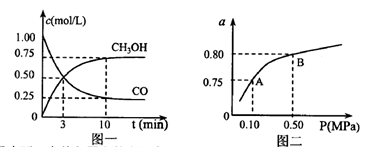
£Ø4£©Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚĢå»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦¢Ś£¬æÉÅŠ¶ĻøĆ·“Ó¦ŅŃ¾“ļµ½Ę½ŗāµÄŹĒ____”££ØÓĆĻąÓ¦×ÖÄø±ķŹ¾£©
| A£®ČŻĘ÷ÖŠ×ÜŃ¹Ēæ²»±ä |
| B£®»ģĢØĘųĢåµÄĘ½¾łÄ¦¶ūÖŹĮæŅ²Ź¼ÖÕ±£³Ö²»±ä£¬ |
| C£®»ģŗĻĘųĢåµÄĆÜ¶Č²»±ä |
| D£®CO2(g)»ņCO(g)µÄÅØ¶Č²»±ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŌŚŅ»¹Ģ¶ØČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÄŚ¼ÓČė0.2molµÄN2ŗĶ0.6molµÄH2£¬ŌŚŅ»¶ØĢõ¼žĻĀ·¢ÉśČēĻĀ·“Ó¦£ŗN2(g)£«3H2(g) 2NH3(g) ”÷H£¼0 ”£·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆĒéæöČēĻĀĶ¼ĖłŹ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
2NH3(g) ”÷H£¼0 ”£·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆĒéæöČēĻĀĶ¼ĖłŹ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ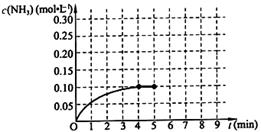
øł¾ŻĶ¼£¬¼ĘĖć“Ó·“Ó¦æŖŹ¼µ½Ę½ŗāŹ±£¬Ę½¾ł·“Ó¦ĖŁĀŹv(NH3)= ”£
¢ĘĻĀĮŠĆčŹöÖŠÄÜĖµĆ÷ÉĻŹö·“Ó¦ŅŃ“ļĘ½ŗāµÄŹĒ ”£
| A£®3vÕż£ØH2£©£½2vÄę£ØNH3£© |
| B£®ČŻĘ÷ÖŠĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓĮæ²»Ėꏱ¼ä¶ų±ä»Æ |
| C£®ČŻĘ÷ÖŠĘųĢåµÄĆÜ¶Č²»Ėꏱ¼ä¶ų±ä»Æ |
| D£®ČŻĘ÷ÖŠĘųĢåµÄ·Ö×Ó×ÜŹż²»Ėꏱ¼ä¶ų±ä»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
£Ø14·Ö£©£Ø1£©ŌŚ¹Ģ¶ØČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠĶØČėNOŗĶCOø÷2mol·¢Éś·“Ó¦£ŗ
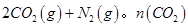 ĖęĪĀ¶Č£ØT£©”¢Ń¹Ēæ£ØP£©ŗĶŹ±¼ä£Øt£©µÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
ĖęĪĀ¶Č£ØT£©”¢Ń¹Ēæ£ØP£©ŗĶŹ±¼ä£Øt£©µÄ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ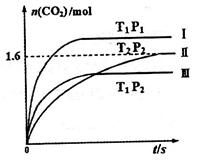
¢ŁĒśĻßI”¢II”¢III¶ŌÓ¦·“Ó¦“ÓæŖŹ¼µ½Ę½ŗāŹ±ÓĆCO2±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹ·Ö±šĪŖ ”¢
Ӣ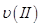 Ӣ
”¢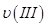 £¬ŌņČżÕߓ󊔹ŲĻµĪŖ______________”£
£¬ŌņČżÕߓ󊔹ŲĻµĪŖ______________”£
¢ŚøĆ·“Ó¦”÷H__________0(Ģī”°£¾”±”¢”°£½”±»ņ”°£¼”±)£»ĒśĻßII¶ŌÓ¦Ę½ŗā³£ŹżK=_________£»ĒśĻßII¶ŌÓ¦µÄ·“Ó¦“ļĘ½ŗāŗó£¬ŌŁĶØČė2molNOŗĶ2molCO²¢±£³ÖĪĀ¶Č²»±ä£¬ŌņŌŁ“ļĘ½ŗāŹ±NOµÄ×Ŗ»ÆĀŹ½«_______£ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£
£Ø2£©¢Ł25”ꏱ£¬½«0.2mol/LµÄHCOOHČÜŅŗÓė0.2mol/LµÄNaOH ČÜŅŗµČĢå»ż»ģŗĻ£¬³ä·Ö·“Ó¦ŗó²āµĆČÜŅŗpHĪŖ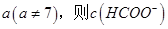 ________
________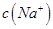 £ØĢī”°£¾”±”¢”°=”±»ņ”°£¼”±£©£¬ŌņHCOO-µÄĖ®½āĘ½ŗā³£Źż£ØKh£©æɽüĖʱķŹ¾ĪŖ______________£ØÓĆŗ¬aµÄ“śŹżŹ½±ķŹ¾£©”£
£ØĢī”°£¾”±”¢”°=”±»ņ”°£¼”±£©£¬ŌņHCOO-µÄĖ®½āĘ½ŗā³£Źż£ØKh£©æɽüĖʱķŹ¾ĪŖ______________£ØÓĆŗ¬aµÄ“śŹżŹ½±ķŹ¾£©”£
¢ŚŅ»¶ØĪĀ¶ČĻĀ£¬0.2mol/Lr HCOOHČÜŅŗ¼ÓĖ®Ļ”ŹĶ¹ż³ĢÖŠ£¬ĻĀĮŠø÷ĻīÖŠĖę׿ÓĖ®ĮæµÄŌö¼Ó¶ų¼õŠ”µÄŹĒ____________£ØĢīŠ“×ÖÄøŠņŗÅ£©”£
a.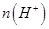 b.
b.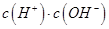 c.
c.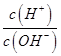 d.
d.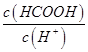
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
ŃŠ¾æNO2”¢SO2”¢COµČ“óĘųĪŪČ¾ĪļµÄ“¦Ąķ¾ßÓŠÖŲŅŖŅāŅ唣NO2æÉÓĆĻĀĮŠ·“Ó¦Ą““¦Ąķ£ŗ
6 NO2(g)+8NH3(g)  7N2(g)+12H2O(g)+Q£ØQ£¾0£©”£
7N2(g)+12H2O(g)+Q£ØQ£¾0£©”£
Ķź³ÉĻĀĮŠĢīæÕ£ŗ
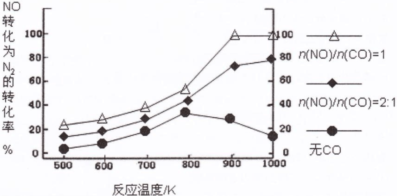
£Ø1£©·“Ó¦µÄĘ½ŗā³£Źż“󣬓¦ĄķNO2µÄŠ§ĀŹøß”£Ōö“óøĆ·“Ó¦Ę½ŗā³£ŹżµÄ“ėŹ©ÓŠ ”£
£Ø2£©Ņ»¶ØĢõ¼žĻĀÉĻŹö·“Ó¦ŌŚÄ³Ģå»ż¹Ģ¶ØµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬ÄÜĖµĆ÷øĆ·“Ó¦ŅŃ¾“ļµ½Ę½ŗāדĢ¬µÄŹĒ ”£
a£®c(NO2)£ŗc(NH3) = 3£ŗ4 b£®6v(NO2) = 7v(N2)
c£®ČŻĘ÷ÄŚĘųĢå×ÜŃ¹Ēæ²»ŌŁ±ä»Æ d£®ČŻĘ÷ÄŚĘųĢåĆÜ¶Č²»ŌŁ±ä»Æ
£Ø3£©ČōĘ½ŗāŹ±NO2ŗĶN2µÄÅضČÖ®±ČĪŖm/n£¬±£³ÖĘäĖüĢõ¼ž²»±ä£¬ĖõŠ”·“ӦȯĘ÷µÄĢå»żŗó“ļµ½ŠĀµÄĘ½ŗā£¬“ĖŹ±NO2ŗĶN2µÄÅضČÖ®±Č m/n£ØĢī”°>”±”¢”°=”±»ņ”°<”±£©”£
£Ø4£©Ä³ĪĀ¶ČĻĀ£¬ŌŚŅ»øöČŻ»żĪŖ2ÉżµÄ·“ӦȯĘ÷ÄŚ£¬ÉĻŹö·“Ó¦2·ÖÖÓŗó“ļµ½Ę½ŗā£¬²āµĆøÕŗĆÓŠ3molµē×Ó·¢Éś×ŖŅĘ£¬ŌņŌŚ2·ÖÖÓÄŚNH3µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ£ŗ
v(NH3) = ӣ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
£Ø1£©³£ĪĀĻĀ£¬½«2ÖÖŅ»ŌŖĖį·Ö±šŗĶNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬ŹµŃ鏿¾ŻČēĻĀ£ŗ
| ×鱚 | Ņ»ŌŖĖį | NaOH | pH |
| ¼× | c(HX)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| ŅŅ | c(HY)=c1mol/L | c(NaOH)=0.1mol/L | pH=7 |
 CH3OH(g) ”÷H
CH3OH(g) ”÷H| ĪĀ¶Č | 523K | 573K | 623K |
| Ę½ŗā³£Źż(K) | 2.041 | 0.270 | 0.012 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĪŹ“šĢā
£Ø16·Ö£©NOŗĶNO2ŹĒ³£¼ūµÄµŖŃõ»ÆĪļ£¬ŃŠ¾æĖüĆĒµÄ×ŪŗĻĄūÓĆÓŠÖŲŅŖŅāŅ唣
£Ø1£©µŖŃõ»ÆĪļ²śÉśµÄ»·¾³ĪŹĢāÓŠ £ØĢīŅ»ÖÖ£©”£
£Ø2£©Ńõ»Æ”Ŗ»¹Ō·ØĻū³żµŖŃõ»ÆĪļµÄ×Ŗ»ÆČēĻĀ£ŗ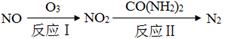
¢Ł·“Ó¦¢ńĪŖ£ŗNO£«O3£½NO2£«O2£¬Éś³É11.2 L O2£Ø±ź×¼×“æö£©Ź±£¬×ŖŅʵē×ÓµÄĪļÖŹµÄĮæŹĒ mol”£
¢Ś·“Ó¦¢ņÖŠ£¬µ±n(NO2)”Ćn[CO(NH2)2]£½3”Ć2Ź±£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ ”£
£Ø3£©Ļõ»Æ·ØŹĒŅ»ÖÖ¹ÅĄĻµÄÉś²śĮņĖįµÄ·½·Ø£¬Ķ¬Ź±ŹµĻÖĮĖµŖŃõ»ÆĪļµÄŃ»·×Ŗ»Æ£¬Ö÷ŅŖ·“Ó¦ĪŖ£ŗ
NO2(g)£«SO2(g) SO3(g)£«NO(g) ”÷H£½£41.8 kJ”¤mol£1
SO3(g)£«NO(g) ”÷H£½£41.8 kJ”¤mol£1
¢ŁŅŃÖŖ£ŗ2SO2(g)£«O2(g) 2SO3(g) ”÷H£½£196.6 kJ”¤mol£1
2SO3(g) ”÷H£½£196.6 kJ”¤mol£1
Š“³öNOŗĶO2·“Ӧɜ³ÉNO2µÄČČ»Æѧ·½³ĢŹ½ ”£
¢ŚŅ»¶ØĪĀ¶ČĻĀ£¬Ļņ2 LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėNO2ŗĶSO2ø÷1 mol£¬5min“ļµ½Ę½ŗā£¬“ĖŹ±ČŻĘ÷ÖŠNO ŗĶNO2µÄÅضČÖ®±ČĪŖ3”Ć1£¬ŌņNO2µÄĘ½ŗā×Ŗ»ÆĀŹŹĒ ”£
¢ŪÉĻŹö·“Ó¦“ļĘ½ŗāŗó£¬ĘäĖüĢõ¼ž²»±äŹ±£¬ŌŁĶłČŻĘ÷ÖŠĶ¬Ź±³äČė
NO2”¢SO2”¢SO3”¢NOø÷1mol£¬Ę½ŗā £ØĢīŠņŗÅ£©”£
A£®ĻņÕż·“Ó¦·½ĻņŅʶÆ
B£®ĻņÄę·“Ó¦·½ĻņŅʶÆ
C£®²»ŅʶÆ
£Ø4£©Ä³»ÆѧŠĖȤŠ”×é¹¹Ļė½«NO×Ŗ»ÆĪŖHNO3£¬×°ÖĆČēĶ¼£¬µē¼«ĪŖ¶ąæ׶čŠŌ²ÄĮĻ”£Ōņøŗ¼«µÄµē¼«·“Ó¦Ź½ŹĒ ”£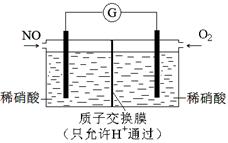
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com