


科目:高中化学 来源: 题型:
| A、无水CuSO4不会溶解,xg粉末质量不变 |
| B、含18O的SO42-进入溶液,白色粉末变成蓝色晶体,其质量大于xg |
| C、含18O的SO42-进入溶液,白色粉末变成蓝色晶体,其质量等于xg |
| D、溶解平衡被破坏,达到新的平衡时有部分含18O的SO42-进入溶液,固体粉末小于xg |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
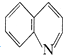 )是一种重要的有机化合物,其合成路线如下:
)是一种重要的有机化合物,其合成路线如下: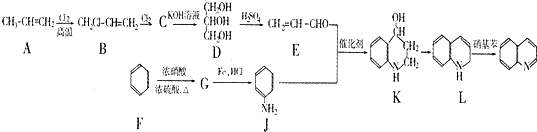
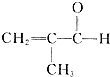 制备物质K的同系物:
制备物质K的同系物:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
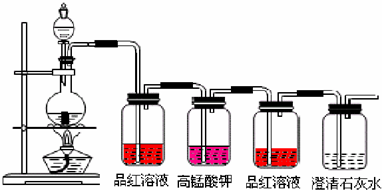
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com