
【题目】把500 mL有BaCl2和KCl的混合溶液分成2等份,一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A.0.1(b-2a)mol/LB.0.4( 2a-b)mol/L
C.10(b-2a)mol/LD.4(b-2a)mol/L
【答案】D
【解析】
混合溶液分成两等份,每份溶液浓度相同,一份加入含a mol硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份溶液中n(Ba2+)=n(Na2SO4);另一份加入含b mol硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+),再利用电荷守恒可知,每份溶液中2n(Ba2+)+n(K+)=n(Cl-),据此计算每份中n(K+),根据![]() 计算钾离子浓度。
计算钾离子浓度。
混合溶液分成两等份,每份溶液的浓度相同,一份加入含a mol硫酸钠的溶液,发生反应Ba2++SO42-=BaSO4↓,恰好使钡离子完全沉淀,可知该份溶液中n(Ba2+)=n(Na2SO4)=a mol;另一份加入含b mol硝酸银的溶液,发生反应Ag++Cl-=AgCl↓,恰好使氯离子完全沉淀,则n(Cl-)=n(Ag+)=b mol,根据电荷守恒可知,每份溶液中2n(Ba2+)+n(K+)=n(Cl-),每份溶液中n(K+)=n(Cl-)-2n(Ba2+)=(b-2a)mol,溶液具有均一性,则原溶液中钾离子浓度为:![]() ,D项正确;
,D项正确;
答案选D。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一学生设计入图所示装置进行NaHCO3的分解,并证实产物中有CO2产生。
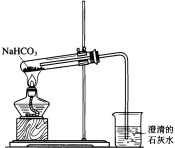
(1)试管中发生的化学反应方程式是____________________________。
(2)指出该学生设计的装置图的错误之处,并改正(文字说明即可)(至少2处)____________。
(3)烧杯中发生反应的离子方程式是_______________________________。
(4)如果将16.8gNaHCO3加热一段时间,然后将剩余固体溶于水,并加入足量的CaCl2溶液,最终得到白色沉淀5.0g,则NaHCO3分解百分率为______________,加CaCl2后反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水体中部分含氮有机物循环如图1所示.
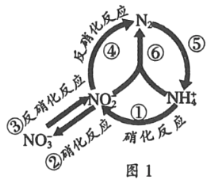
(1)图中属于氮的固定的是____ (填序号).
(2)图中①②的转化是在亚硝化细菌和硝化细菌作用下进行的,已知:
2NH4+(aq)+3O2═2NO2﹣(aq)+4H+(aq)+2H2O(l)△H1=﹣556.8kJ/mol
2NO2﹣(aq)+O2(g)=2NO3﹣(aq);△H2=﹣145.2kJmol﹣1
则反应NH4+(aq)+2O2(g)=NO3﹣(aq)+2H+(aq)+H2O(1)△H3=____kJmol﹣1
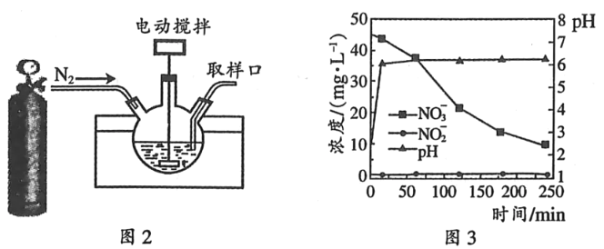
(3)某科研机构研究通过化学反硝化的方法除脱水体中过量的NO3﹣,他们在图示的三颈烧瓶中(装置如图2)中,加入NO3﹣起始浓度为45mgL﹣1的水样、自制的纳米铁粉,起始时pH=2.5,控制水浴温度为25℃、搅拌速率为500转/分,实验中每间隔一定时间从取样口检测水体中NO3﹣、NO2﹣及pH(NH4+、N2未检测)的相关数据(如图3).
①实验室可通过反应Fe(H2O)62++2BH4﹣=Fe↓+2H3BO3+7H2↑制备纳米铁粉,每生成1molFe转移电子总的物质的量为____.
②向三颈烧瓶中通入N2的目的是____.
③开始反应0~20min,pH快速升高到约6.2,原因之一是___________;NO3﹣还原为NH4+及少量在20~250min时,加入缓冲溶液维持pH6.2左右,NO3﹣主要还原为NH4+,Fe转化为Fe(OH)2,该反应的离子方程式为___
(4)一种可以降低水体中NO3﹣含量的方法是:在废水中加入食盐后用特殊电极进行电解反硝化脱除,原理可用图4简要说明.
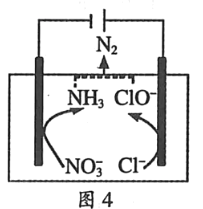
①电解时,阴极的电极反应式为_____.
②溶液中逸出N2的离子方程式为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下图中序号①~④仪器的名称:
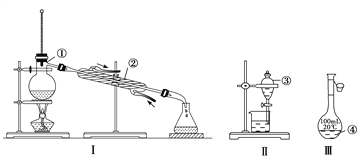
①___________;②___________; ③___________; ④___________。
(2)仪器①~④中,使用时必须检查是否漏水的有__________(填仪器序号)。
(3)右图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。现用该浓硫酸配制480 mL 1 mol·L-l的稀硫酸。

可供选用的仪器有: ①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
①配制稀硫酸时,还缺少的仪器有__________、__________(写仪器名称)。
②经计算,配制480 mL l mol·L-l的稀硫酸需要用量筒量取上述浓硫酸的体积为________mL。将量取好的浓硫酸缓慢注入到盛水的烧杯后,发现量筒里还残留有浓硫酸,如果用蒸馏水洗涤后一并将洗涤液注入烧杯,将使结果浓度______(填“偏高”“偏低”或“无影响”)。
③在转入容量瓶前烧杯中液体应_______,否则会使结果浓度____(填“偏高”“偏低”或“无影响”)。
④定容时必须使溶液的凹液面与刻度线相平,若俯视会使浓度______。(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应A(g)+B(g)![]() C(g),若反应物A的浓度从2 mol·L-1降到0.8 mol·L-1需20 s,则反应物A的浓度由0.8 mol·L-1降到0.2 mol·L-1所需的反应时间( )
C(g),若反应物A的浓度从2 mol·L-1降到0.8 mol·L-1需20 s,则反应物A的浓度由0.8 mol·L-1降到0.2 mol·L-1所需的反应时间( )
A. 等于10 sB. 大于10 sC. 小于10 sD. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是
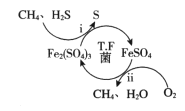
A. 该脱硫过程需要不断添加Fe2(SO4)3溶液
B. 脱硫过程O2间接氧化H2S
C. 亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
D. 《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com