
”¾ĢāÄæ”æĒāÄÜŹĒ·¢Õ¹ÖŠµÄŠĀÄÜŌ“£¬ĖüµÄĄūÓĆ°üĄØĒāµÄÖʱø”¢“¢“ęŗĶÓ¦ÓĆČżøö»·½Ś”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ÓėĘūÓĶĻą±Č£¬ĒāĘų×÷ĪŖČ¼ĮĻµÄÓŵćŹĒ_________(ÖĮÉŁ“š³öĮ½µć)”£µ«ŹĒĒāĘųÖ±½ÓČ¼ÉÕµÄÄÜĮæ×Ŗ»»ĀŹŌ¶µĶÓŚČ¼ĮĻµē³Ų£¬Š“³ö¼īŠŌĒāŃõČ¼ĮĻµē³ŲµÄøŗ¼«·“Ó¦Ź½£ŗ____________”£
£Ø5£©»Æ¹¤Éś²śµÄø±²śĒāŅ²ŹĒĒāĘųµÄĄ“Ō“”£µē½ā·ØÖĘȔӊ¹ć·ŗÓĆĶ¾µÄNa2FeO4£¬Ķ¬Ź±»ńµĆĒāĘų£ŗFe+2H2O+2OH![]() FeO42+3H2”ü£¬¹¤×÷ŌĄķČēĶ¼1ĖłŹ¾”£×°ÖĆĶصēŗó£¬Ģśµē¼«ø½½üÉś³É×ĻŗģÉ«µÄFeO42£¬Äųµē¼«ÓŠĘųÅŻ²śÉś”£ČōĒāŃõ»ÆÄĘČÜŅŗÅØ¶Č¹żøߣ¬Ģśµē¼«Ēų»į²śÉśŗģŗÖÉ«ĪļÖŹ”£ŅŃÖŖ£ŗNa2FeO4Ö»ŌŚĒæ¼īŠŌĢõ¼žĻĀĪČ¶Ø£¬Ņ×±»H2»¹Ō”£
FeO42+3H2”ü£¬¹¤×÷ŌĄķČēĶ¼1ĖłŹ¾”£×°ÖĆĶصēŗó£¬Ģśµē¼«ø½½üÉś³É×ĻŗģÉ«µÄFeO42£¬Äųµē¼«ÓŠĘųÅŻ²śÉś”£ČōĒāŃõ»ÆÄĘČÜŅŗÅØ¶Č¹żøߣ¬Ģśµē¼«Ēų»į²śÉśŗģŗÖÉ«ĪļÖŹ”£ŅŃÖŖ£ŗNa2FeO4Ö»ŌŚĒæ¼īŠŌĢõ¼žĻĀĪČ¶Ø£¬Ņ×±»H2»¹Ō”£
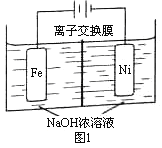

¢Łµē½āŅ»¶ĪŹ±¼äŗó£¬c(OH)½µµĶµÄĒųÓņŌŚ_______(Ģī”°Ņõ¼«ŹŅ”±»ņ”°Ńō¼«ŹŅ”±)”£
¢Śµē½ā¹ż³ĢÖŠ£¬Šė½«Ņõ¼«²śÉśµÄĘųĢå¼°Ź±Åųö£¬ĘäŌŅņŹĒ_______”£
¢Ūc( Na2FeO4)Ėę³õŹ¼c(NaOH)µÄ±ä»ÆČēĶ¼2£¬ČĪŃ”M”¢NĮ½µćÖŠµÄŅ»µć£¬·ÖĪöc(Na2FeO4)µĶÓŚ×īøßÖµµÄŌŅņ£ŗ_____________”£
”¾“š°ø”æ
£Ø1£©ĪŪČ¾Š”£»æÉŌŁÉś£»Ą“Ō“¹ć£»×ŹŌ“·įø»£»Č¼ÉÕČČÖµøߣ»H2+2OH--2e-=2H2O
£Ø5£©¢ŁŃō¼«ŹŅ
¢Ś·ĄÖ¹Na2FeO4ÓėH2·“Ó¦Ź¹²śĀŹ½µµĶ
¢ŪMµć£ŗc(OH-)µĶ£¬Na2FeO4ĪČ¶ØŠŌ²ī£¬ĒŅ·“Ó¦Āż(»ņNµć£ŗc(OH-)¹żøߣ¬Ģśµē¼«ÉĻÓŠĒāŃõ»ÆĢśÉś³É£¬Ź¹Na2FeO4²śĀŹ½µµĶ)”£
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©ÓėĘūÓĶĻą±Č£¬ĒāĘų×÷ĪŖČ¼ĮĻµÄÓŵćÓŠĪŪČ¾Š”£»æÉŌŁÉś£»Ą“Ō“¹ć£»×ŹŌ“·įø»£»Č¼ÉÕČČÖµøßµČ£¬¼īŠŌĒāŃõČ¼ĮĻµē³ŲµÄøŗ¼«·“Ó¦Ź½ĪŖH2+2OH--2e-=2H2O£¬¹Ź“š°øĪŖ£ŗĪŪČ¾Š”£»æÉŌŁÉś£»Ą“Ō“¹ć£»×ŹŌ“·įø»£»Č¼ÉÕČČÖµøߣ»H2+2OH--2e-=2H2O
£Ø5£©¢Łøł¾ŻĢāŅāÄųµē¼«ÓŠĘųÅŻ²śÉśŹĒĒāĄė×ӷŵēÉś³ÉĒāĘų£¬Ģśµē¼«·¢ÉśŃõ»Æ·“Ó¦£¬ČÜŅŗÖŠµÄĒāŃõøłĄė×Ó¼õÉŁ£¬Ņņ“Ėµē½āŅ»¶ĪŹ±¼äŗó£¬c(OH)½µµĶµÄĒųÓņŌŚŃō¼«ŹŅ£¬¹Ź“š°øĪŖ£ŗŃō¼«ŹŅ£»
¢ŚĒāĘų¾ßÓŠ»¹ŌŠŌ£¬øł¾ŻĢāŅāNa2FeO4Ö»ŌŚĒæ¼īŠŌĢõ¼žĻĀĪČ¶Ø£¬Ņ×±»H2»¹Ō”£µē½ā¹ż³ĢÖŠ£¬Šė½«Ņõ¼«²śÉśµÄĘųĢå¼°Ź±Åųö£¬·ĄÖ¹Na2FeO4ÓėH2·“Ó¦Ź¹²śĀŹ½µµĶ£¬¹Ź“š°øĪŖ£ŗ·ĄÖ¹Na2FeO4ÓėH2·“Ó¦Ź¹²śĀŹ½µµĶ£»
¢Ūøł¾ŻĢāŅāNa2FeO4Ö»ŌŚĒæ¼īŠŌĢõ¼žĻĀĪČ¶Ø£¬ŌŚMµć£¬c(OH-)µĶ£¬Na2FeO4ĪČ¶ØŠŌ²ī£¬ĒŅ·“Ó¦Āż£¬ŌŚNµć£ŗc(OH-)¹żøߣ¬Ģśµē¼«ÉĻÓŠĒāŃõ»ÆĢśÉś³É£¬Ź¹Na2FeO4²śĀŹ½µµĶ£¬¹Ź“š°øĪŖ£ŗMµć£ŗc(OH-)µĶ£¬Na2FeO4ĪČ¶ØŠŌ²ī£¬ĒŅ·“Ó¦Āż(»ņNµć£ŗc(OH-)¹żøߣ¬Ģśµē¼«ÉĻÓŠĒāŃõ»ÆĢśÉś³É£¬Ź¹Na2FeO4²śĀŹ½µµĶ)”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”放2016½ģĢĘɽ¶žÄ£”æŃĒĻõĖįÄĘŹĒŅ»ÖÖ¹¤ŅµŃĪ£¬Ķā¹ŪÓėŹ³ŃĪ·Ē³£ĻąĖĘ£¬¶¾ŠŌ½ĻĒ攣ij»ÆѧŠĖȤŠ”×é¶ŌŹ³ŃĪÓėŃĒĻõĖįÄĘ½ųŠŠ¶ą½Ē¶ČĢ½¾æ£ŗ
£ØŅ»£©¼ų±šNaClŗĶNaNO2
¼×Ķ¬Ń§ÓĆ³Įµķ·ÖĪö·Ø
¾²é£ŗ³£ĪĀĻĀKsp(AgNO2)=2”Į10-8£¬ Ksp(AgCl)=1.8”Į10-10£®·Ö±šĻņŹ¢ÓŠ5mL 0.0001 mol/LĮ½ÖÖŃĪČÜŅŗµÄŹŌŗĻÖŠĶ¬Ź±ÖšµĪµĪ¼Ó0.0001mol/LĻõĖįŅųČÜŅŗ£¬ĻČÉś³É³ĮµķµÄŹĒ×°ÓŠ ČÜŅŗµÄŹŌ¹Ü”£
ŅŅĶ¬Ń§²ą¶ØČÜŅŗpH
ÓĆpHŹŌÖ½·Ö±š²ā¶Ø0.1 mol/LĮ½ÖÖŃĪČÜŅŗµÄpH£¬²āµĆNaNO2ČÜŅŗ³Ź¼īŠŌ”£øĆČÜŅŗ³Ź¼īŠŌµÄŌŅņŹĒ £ØÓĆĄė×Ó·½³ĢŹ½½āŹĶ£©”£
£Ø¶ž£©øĆŠ”×éÓĆČēĻĀ×°ÖĆ£ØĀŌČ„¼Š³ÖŅĒĘ÷£©ÖʱøŃĒĻõĖįÄĘ

ŅŃÖŖ£ŗ¢Ł 2NO+ Na2O2 = 2NaNO2 £»
¢Ś ĖįŠŌĢõ¼žĻĀ£¬NOŗĶNO2¶¼ÄÜÓėMnO4Ņ»·“Ӧɜ³ÉNO3Ņ»ŗĶMn2+”¤
£Ø1£©Ź¹ÓĆĶĖæµÄÓŵćŹĒ ”£
£Ø2£©×°ÖĆAÖŠ·“Ó¦·½³ĢŹ½ĪŖ ”£
×°ÖĆC ÖŠŹ¢·ÅµÄŅ©Ę·ŹĒ £»£ØĢī×ÖÄø“śŗÅ£©
A£®ÅØĮņĖį B£®NaOH ČÜŅŗ C£®Ė® D£®ĖÄĀČ»ÆĢ¼
ŅĒĘ÷FµÄ×÷ÓĆ ”£
£Ø3£©øĆŠ”×é³ĘČ”5.000gÖĘČ”µÄѳʷČÜÓŚĖ®Åä³É250.0 mLČÜŅŗ£¬Č”25.00mLČÜŅŗӌ׶ŠĪĘæÖŠ£¬ÓĆ0.1000mol/LĖįŠŌKMnO4ČÜŅŗ½ųŠŠµĪ¶Ø£¬ŹµŃéĖłµĆŹż¾ŻČēĻĀ±ķĖłŹ¾£ŗ
µĪ¶Ø“ĪŹż | 1 | 2 | 3 | 4 |
ĻūŗÄKMnO4ČÜŅŗĢå»ż/mL | 20.70 | 20.12 | 20.00 | 19.88 |
¢Ł µŚŅ»“ĪŹµŃ鏿¾Ż³öĻÖŅģ³££¬Ōģ³ÉÕāÖÖŅģ³£µÄŌŅņæÉÄÜŹĒ £ØĢī×ÖÄø“śŗÅ£©”£
A£®×¶ŠĪĘæĻ“¾»ŗóĪ“øÉŌļ
B£®ĖįŹ½µĪ¶Ø¹ÜÓĆÕōĮóĖ®Ļ“¾»ŗóĪ“ÓƱź×¼ŅŗČóĻ“
C£®µĪ¶ØÖÕµćŹ±ŃöŹÓ¶ĮŹż
¢ŚĖįŠŌKMnO4ČÜŅŗµĪ¶ØŃĒĻõĖįÄĘČÜŅŗµÄĄė×Ó·½³ĢŹ½ĪŖ ”£
¢ŪøĆѳʷ֊ŃĒĻõĖįÄʵÄÖŹĮæ·ÖŹżĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫µČĪļÖŹµÄĮæµÄA”¢B»ģŗĻÓŚ2LĆܱÕČŻĘ÷ÖŠ·¢ÉśČēĻĀ·“Ó¦£ŗ3A£Øg£©+B£Øg£© ![]() xC£Øg£©+2D£Øg£©£¬4minŹ±²āµĆDµÄÅضČĪŖ0.4mol/L£¬c£ØA£©:c£ØB£©=3:5£¬CµÄĘ½¾ł·“Ó¦ĖŁĀŹŹĒ0.1mol/£ØL£®min£©£¬ĮŠŹ½¼ĘĖć£ŗ
xC£Øg£©+2D£Øg£©£¬4minŹ±²āµĆDµÄÅضČĪŖ0.4mol/L£¬c£ØA£©:c£ØB£©=3:5£¬CµÄĘ½¾ł·“Ó¦ĖŁĀŹŹĒ0.1mol/£ØL£®min£©£¬ĮŠŹ½¼ĘĖć£ŗ
£Ø1£©x=__________£»
£Ø2£©BŌŚÕā4minÄŚµÄĘ½¾ł·“Ó¦ĖŁĀŹ__________£»
£Ø3£©“ĖŹ±AµÄÅØ¶Č¼°·“Ó¦æŖŹ¼Ē°ČŻĘ÷ÖŠA”¢BµÄĪļÖŹµÄĮæ__________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃŠ¾æČĖŌ±·¢ĻÖĮĖŅ»ÖÖ”°Ė®”±µē³Ų£¬Ęä×Ü·“Ó¦ĪŖ£ŗ5MnO2 +2Ag+2NaCl =Na2 Mn5O10 +2AgCl”£ČēĶ¼ÓĆ”°Ė®”±µē³ŲĪŖµēŌ“µē½āNaCIČÜŅŗµÄŹµŃéÖŠ£¬Xµē¼«ÉĻÓŠĪŽÉ«ĘųĢåŅŻ³ö”£ĻĀĮŠÓŠ¹Ų·ÖĪöÕżČ·µÄŹĒ£Ø £©

A£®IĪŖøŗ¼«£¬Ęäµē¼«·“Ó¦Ź½ĪŖAgŹ®Cl-+e-=AgCl
B£®”°Ė®”±µē³ŲÄŚNa+²»¶ĻĻņøŗ¼«×÷¶ØĻņŅʶÆ
C£®Ćæ×ŖŅĘ1mole-£¬UŠĶ¹ÜÖŠĻūŗÄ0£®5mol H2O
D£®æŖŹ¼Ź±UŠĶ¹ÜÖŠY¼«ø½½üpHÖš½„Ōö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĢõ¼žĻĀ£¬½«3molAŗĶ1molBĮ½ÖÖĘųĢå»ģŗĻÓŚ¹Ģ¶ØČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśČēĻĀ·“Ó¦£ŗ3A(g)+B(g)![]() xC(g)+2D(s)”£2minÄ©øĆ·“Ó¦“ļµ½Ę½ŗā£¬Éś³É0.8molD£¬²¢²āµĆCµÄÅضČĪŖ0.2mol/L”£ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ
xC(g)+2D(s)”£2minÄ©øĆ·“Ó¦“ļµ½Ę½ŗā£¬Éś³É0.8molD£¬²¢²āµĆCµÄÅضČĪŖ0.2mol/L”£ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ
A. “ÓæŖŹ¼µ½Ę½ŗāAµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.3mol/(L![]() s)
s)
B. “ÓæŖŹ¼µ½Ę½ŗāBµÄ×Ŗ»ÆĀŹĪŖ60%
C. “Ė·“Ó¦µÄ»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½![]()
D. Čō»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁøı䏱£¬øĆ·“Ó¦Ņ»¶Ø“ļµ½Ę½ŗāדĢ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·įø»µÄCO2ĶźČ«æÉŅŌ×÷ĪŖŠĀĢ¼Ō“£¬½ā¾öµ±Ē°Ó¦ÓĆ×ī¹ć·ŗµÄĢ¼Ō“£ØŹÆÓĶŗĶĢģČ»Ęų£©µ½±¾ŹĄ¼ĶÖŠŅ¶½«æŻ½ßµÄĪ£»ś”£
£Ø1£©ÄæĒ°¹¤ŅµÉĻÓŠŅ»ÖÖ·½·ØŹĒÓĆCO2ŗĶH2ŌŚ230”ę“߻ƼĮĢõ¼žĻĀ×Ŗ»ÆÉś³É¼×“¼£ØCH3OH£©ÕōĘūŗĶĖ®ÕōĘųCO2£Øg£©+3H2£Øg£©![]() CH3OH£Øg£©+H2O£Øg£©”£ĻĀĶ¼±ķŹ¾ŗćŃ¹ČŻĘ÷ÖŠ³äČė1mol CO2ŗĶ3 mol H2£¬×Ŗ»ÆĀŹ“ļ50%Ź±µÄÄÜĮæ±ä»ÆŹ¾ŅāĶ¼”£Š“³öøĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ ”£
CH3OH£Øg£©+H2O£Øg£©”£ĻĀĶ¼±ķŹ¾ŗćŃ¹ČŻĘ÷ÖŠ³äČė1mol CO2ŗĶ3 mol H2£¬×Ŗ»ÆĀŹ“ļ50%Ź±µÄÄÜĮæ±ä»ÆŹ¾ŅāĶ¼”£Š“³öøĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½£ŗ ”£

£Ø2£©ĮķĶā¹¤ŅµÉĻ»¹æÉÓĆCOŗĶH2Öʱø¼×“¼”£ ·“Ó¦ĪŖCO£Øg£©+2H2£Øg£©![]() CH3OH£Øg£©£¬
CH3OH£Øg£©£¬
ijĪĀ¶ČĻĀ£¬ŌŚČŻ»żĪŖ2LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ½ųŠŠøĆ·“Ó¦£¬ĘäĻą¹ŲŹż¾Ż¼ūĻĀĶ¼£ŗ

¢Ł t minÖĮ2t minŹ±ĖŁĀŹ±ä»ÆµÄŌŅņæÉÄÜŹĒ £»
¢Ś 3t minŹ±¶Ō·“Ó¦ĢåĻµ²ÉČ”ĮĖŅ»øö“ėŹ©£¬ÖĮ4t minŹ±COµÄĪļÖŹµÄĮæĪŖ0.5mol£¬ĒėĶź³ÉÉĻĶ¼COµÄĒśĻß”£
£Ø3£©CO2ŌŚŅ»¶ØĢõ¼žĻĀ£¬»¹æÉŅŌÓėH2ŗĻ³É¶ž¼×ĆŃ£ŗ
2CO2£Øg£©+6H2£Øg£©![]() CH3OCH3£Øg£©+3H2O£Øg£©”£
CH3OCH3£Øg£©+3H2O£Øg£©”£
½«2.5 mol H2Óėb mol CO2ÖĆÓŚČŻ»żĪŖ1 LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśÉĻŹö·“Ó¦£¬“ļµ½Ę½ŗāדĢ¬Ź±£¬²āµĆŹµŃ鏿¾ŻČēĻĀ±ķ£ŗ

¢Ł ½µĪĀŹ±£¬ÉĻŹöĘ½ŗāĻņ_________·½ĻņŅĘ¶Æ£ØĢī”°Õż·“Ó¦”±»ņ”°Äę·“Ó¦”±£©”£
¢Ś±ķÖŠx”¢yµÄ“󊔹ŲĻµĪŖ_________”£
A£®x£½y B£®x£¾y C£®x£¼y D£®ĪŽ·ØÅŠ¶Ļ
¢Ū±ķÖŠx”¢y”¢z”¢w¶ŌÓ¦µÄĘ½ŗā³£Źż·Ö±šĪŖKx”¢Ky”¢Kz”¢Kw£¬ĖüĆĒÖ®¼äµÄ“󊔹ŲĻµĪŖ___________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ“߻ƻ¹ŌCO2ŹĒ½ā¾öĪĀŹŅŠ§Ó¦¼°ÄÜŌ“ĪŹĢāµÄÖŲŅŖŹÖ¶ĪÖ®Ņ»”£ŃŠ¾æ±ķĆ÷£¬ŌŚCu/ZnO“߻ƼĮ“ęŌŚĻĀ£¬CO2ŗĶH2æÉ·¢ÉśĮ½øöĘ½ŗā·“Ó¦£¬·Ö±šÉś³ÉCH3OHŗĶCO”£·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ČēĻĀ£ŗ
CO2£Øg£©+3 H2£Øg£©![]() CH3OH£Øg£©+H2O£Øg£©¦¤H1=-53.7kJ”¤mol-1 I
CH3OH£Øg£©+H2O£Øg£©¦¤H1=-53.7kJ”¤mol-1 I
CO2£Øg£©+ H2£Øg£©![]() CO£Øg£©+H2O£Øg£©¦¤H2 II
CO£Øg£©+H2O£Øg£©¦¤H2 II
ijŹµŃéŹŅæŲÖĘCO2ŗĶH2³õŹ¼Ķ¶ĮĻ±ČĪŖ1:2.2£¬¾¹żĻąĶ¬·“Ó¦Ź±¼ä²āµĆČēĻĀŹµŃ鏿¾Ż£ŗ

”¾±ø×¢”æCat.1:Cu/ZnOÄÉĆ×°ō£»Cat.2:Cu/ZnOÄÉĆ×ʬ£»¼×“¼Ń”ŌńŠŌ£ŗ×Ŗ»ÆµÄCO2ÖŠÉś³É¼×Č©µÄ°Ł·Ö±Č
ŅŃÖŖ£ŗ¢ŁCOŗĶH2µÄ±ź×¼Č¼ÉÕČČ·Ö±šĪŖ-283.0kJ”¤mol-1ŗĶ-285.8kJ”¤mol-1
¢ŚH2O£Øl£©![]() H2O£Øg£© ¦¤H3=44.0kJ”¤mol-1
H2O£Øg£© ¦¤H3=44.0kJ”¤mol-1
Ēė»Ų“š£Ø²»æ¼ĀĒĪĀ¶Č¶Ō¦¤HµÄÓ°Ļģ£©£ŗ
£Ø1£©·“Ó¦IµÄĘ½ŗā³£Źż±ķ“ļŹ½K= £»·“Ó¦IIµÄ¦¤H2= kJ”¤mol-1”£
£Ø2£©ÓŠĄūÓŚĢįøßCO2×Ŗ»ÆĪŖCH3OHĘ½ŗā×Ŗ»ÆĀŹµÄ“ėŹ©ÓŠ ”£
A£®Ź¹ÓĆ“ß»Æ¼ĮCat.1 B£®Ź¹ÓĆ“ß»Æ¼ĮCat.2 C£®½µµĶ·“Ó¦ĪĀ¶Č
D£®Ķ¶ĮĻ±Č²»±ä£¬Ōö¼Ó·“Ó¦ĪļµÄÅØ¶Č E£®Ōö“óCO2ŗĶH2µÄ³õŹ¼Ķ¶ĮĻ±Č
£Ø3£©±ķÖŠŹµŃ鏿¾Ż±ķĆ÷£¬ŌŚĻąĶ¬ĪĀ¶ČĻĀ²»Ķ¬µÄ“߻ƼĮ¶ŌCO2×Ŗ»Æ³ÉCH3OHµÄŃ”ŌńŠŌÓŠĻŌÖųµÄÓ°Ļģ£¬ĘäŌŅņŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĖÄøö²»Ķ¬ČŻĘ÷ÖŠ£¬²»Ķ¬Ģõ¼žĻĀ½ųŠŠŗĻ³É°±·“Ó¦”£øł¾ŻŌŚĻąĶ¬Ź±¼äÄŚ²ā¶ØµÄ½į¹ūÅŠ¶ĻÉś³É°±µÄĖŁĀŹ×īæģµÄŹĒ ( )
A£®v(N2)=0.1mol”¤L-1”¤s-1 B£®v(H2)=0.1mol”¤L-1”¤min-1
C£®v(NH3)=0.15mol”¤L-1”¤min-1 D£®v(H2)=0.3mol”¤L-1”¤min-1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆ1L 1.0molL-1NaOHČÜŅŗĪüŹÕ0.8molSO2£¬ĖłµĆČÜŅŗÖŠµÄSO32-ŗĶHSO3-µÄĪļÖŹµÄĮæÅضČÖ®±Č×ī½Ó½üÓŚ( )
A£®2:1 B£®1:3 C£®3:2 D£®2:3
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com