

| A. | a>b>c>d | B. | b>c>d>a | C. | d>a>b>c | D. | a>b>d>c |
分析 一般来说,由两种金属构成的原电池中,较活泼的金属作负极、较不活泼金属作正极,负极上失电子发生氧化反应、正极上得电子发生还原反应,放电时电解质溶液中阴离子向负极移动,电流从正极流向负极,据此分析解答.
解答 解:一般来说,由两种金属构成的原电池中,较活泼的金属作负极、较不活泼金属作正极,负极上失电子发生氧化反应、正极上得电子发生还原反应,放电时电解质溶液中阴离子向负极移动,电流从正极流向负极,
a、b构成的原电池中,a极质量减小b极质量增加,说明a被腐蚀,b被保护,所以金属活动性a>b;
b、c没有闭合回路,不能构成原电池,b极有气体产生,c极无变化,说明b较活泼,则金属活动性b>c;
c、d构成的原电池中,d极溶解,c极有气体产生,说明d被腐蚀,c被保护,则金属活动性d>c;
a、d构成的原电池中,电流从a极流向d极,说明a作正极,则金属活动性d>a;
通过以上分析知,金属活动性强弱顺序是d>a>b>c;
故选C.
点评 本题考查金属活动性强弱顺序判断,明确原电池中电子流向、电流流向、金属的腐蚀与防护与金属活动性强弱关系即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 光照新制的氯水时,溶液的pH逐渐减小 | |
| B. | 可用浓氯水和氢氧化钠固体快速制取氨气 | |
| C. | 增大压强,有利于SO2与O2反应生成SO3 | |
| D. | 硅酸钠溶液在保存时不应用玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
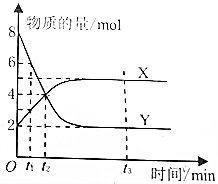 一定温度下,密闭容器内某一反应中X、Y的物质的量随反应时间变化的曲线如图所示,下列叙述中不正确的是( )
一定温度下,密闭容器内某一反应中X、Y的物质的量随反应时间变化的曲线如图所示,下列叙述中不正确的是( )| A. | 反应的化学方程式为:2X?Y | B. | t1时,Y的浓度是X浓度的2倍 | ||
| C. | t2时,正反应速率大于逆反应速率 | D. | t3时,正逆反应速率相等,达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氧化剂与还原剂物质的量之比为3:4 | |
| B. | 该反应中氧化产物与还原产物物质的量之比为1:4 | |
| C. | N是氧化产物,而且是极性分子 | |
| D. | M是还原产物,其还原性比NH3弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
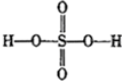 过硫酸:
过硫酸:
 (b)
(b) (c)H2O2(d)
(c)H2O2(d) (e)
(e) (f)
(f) (g)O3(h)
(g)O3(h)

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
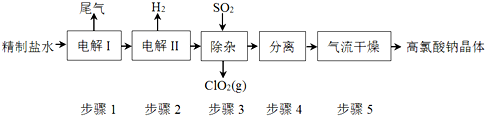
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Cl-CH2Cl 二氯乙烷 | B. | 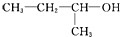 1-甲基-1-丙醇 1-甲基-1-丙醇 | ||
| C. |  1,4-二甲基丁烷 1,4-二甲基丁烷 | D. |  2-乙基-1-丁烯 2-乙基-1-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com