
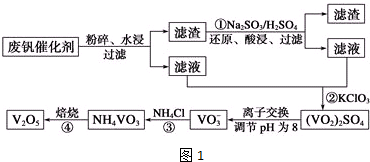
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
分析 反应①是利用亚硫酸钠在酸性溶液中的还原性把难溶的V2O5转化为易溶于水的VOSO4便于钒的提取,反应②是用氯酸钾溶液与VOSO4反应生成(VO2)2SO4,通过离子交换,调节溶液PH得到VO3-,反应③是VO3-溶液与氯化铵反应生成NH4VO3沉淀,反应④加热NH4VO3分解为V2O5,
(1)铝热反应实质是置换反应,铝与五氧化二钒反应生成钒与氧化铝;
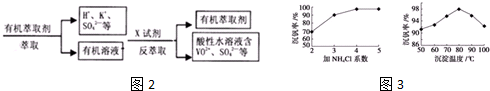
(2)根据废钒催化剂的组成及表中数据判断滤液主要成分;反萃取时加入的X试剂是抑制RSO4(水层)+2HA(有机层)?RA2(有机层)+H2SO4(水层)平衡正向进行;萃取与反萃取过程和用CCl4萃取碘水中的碘都是萃取,则相同点是有机层与水溶液不相溶而分层,不同点是这种萃取与反萃取过程利用平衡移动发生了化学反应,而用CCl4萃取碘水中的碘利用了相似相溶原理是物理溶解;
(3)依据流程中的沉淀分离书写离子方程式;根据题中图象分析坐标系中表示的含义,结合图中的沉矾率与沉淀温度关系选择最佳温度,再根据沉矾率与氯化铵系数选择最佳的氯化铵系数;
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,发生氧化还原反应生成二氧化碳、VO2+和水,离子方程式中一定满足质量守恒和电荷守恒;
(5)电池充电时阳极发生氧化反应,阳极电极反应为VO2+失去电子发生氧化反应生成VO2+.
解答 解:反应①是利用亚硫酸钠在酸性溶液中的还原性把难溶的V2O5转化为易溶于水的VOSO4便于钒的提取,反应②是用氯酸钠溶液与VOSO4反应生成(VO2)2SO4,通过离子交换,调节溶液PH得到NaVO3,反应③是NaVO3溶液与氯化铵反应生成NH4VO3沉淀,反应④加热NH4VO3分解为V2O5,
(1)铝与五氧化二钒反应生成钒与氧化铝,反应方程式为3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3,故答案为:3V2O5+10Al $\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3;
(2)废钒催化剂中含有V2O5、VOSO4及不溶性残渣,由于V2O5为难溶物,所以滤液中含钒的主要成分为VOSO4;
反萃取时加入的X试剂是抑制RSO4(水层)+2HA(有机层)?RA2(有机层)+H2SO4(水层)平衡正向进行,则可以加入硫酸抑制平衡正向进行,所以X试剂是硫酸;
萃取与反萃取过程和用CCl4萃取碘水中的碘都是萃取,则相同点是有机层与水溶液不相溶而分层,不同点是这种萃取与反萃取过程利用平衡移动发生了化学反应,而用CCl4萃取碘水中的碘利用了相似相溶原理是物理溶解;
故答案为:VOSO4 ;硫酸;有机层与水溶液不相溶而分层;这种萃取与反萃取过程利用平衡移动发生了化学反应,而用CCl4萃取碘水中的碘利用了相似相溶原理是物理溶解;
(3)根据NH4VO3难溶于水,利用复分解反应沉淀VO3-,离子方程式为NH4++VO3-=NH4VO3↓,根据沉钒率与沉淀温度的图象可知,在80℃时沉矾率最高为98%,再根据氯化铵系数与沉钒率可知,氯化铵系数为4时沉钒率最高,所以最佳控制氯化铵系数和温度分别为4、80℃,
故答案为:NH4++VO3-=NH4VO3↓;4;80℃;
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,发生氧化还原反应生成二氧化碳、VO2+和水,离子方程式为:2VO2++H2C2O4+2H+═2VOn++2CO2↑+2H2O,故答案为:2VO2++H2C2O4+2H+═2VO2++2CO2↑+2H2O;
(5)阳极反应是氧化反应,由电池总反应可知充电时,阳极电极反应为VO2+失去电子发生氧化反应生成VO2+,则阳极电极反应为VO2++H2O-e-=VO2++2H+,
故答案为:VO2++H2O-e-=VO2++2H+.
点评 本题考查了铝热反应、氧化还原反应、离子反应、电化学等知识,题目难度中等,正确分析、理解工业流程是解题关键,注意明确铝热反应原理及电荷守恒、质量守恒在配平反应方程式中的应用.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 它是副族元素 | |
| B. | 它是第七周期元素 | |
| C. | 它的原子核内有97个质子 | |
| D. | 它的一种同位素的核内有108个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量之比 | B. | 体积比 | C. | 碳、氧原子个数比 | D. | 氢、氧原子个数比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O | |
| B. | 氢氟酸腐蚀玻璃:SiO2+4HF=SiF4↑+2H2O | |
| C. | 硫化钡加入稀硫酸:BaS+2H+=H2S↑+Ba2+ | |
| D. | 铝与氢氧化钠溶液反应:Al+2OH-=AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
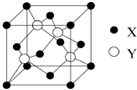 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8 g乙烯与丙烯的混合物中含碳原子的数目为0.2NA | |
| B. | 等物质的量的氢氧根离子(OH-)与羟基(-OH)所含电子数相等 | |
| C. | 常温常压下28 g CO与22.4 L O2所含分子数相等 | |
| D. | 16 g CH4与18 g NH4+所含质子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究SO2和Na2O2可能化合生成Na2SO4 | |
| B. | 探究NO和N2O可能化合生成NO2 | |
| C. | 探究NO2可能被NaOH溶液完全吸收生成NaNO2和NaNO3 | |
| D. | 探究红色酚酞试液通入Cl2褪色,原因是溶液酸碱性改变或被漂白 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com