
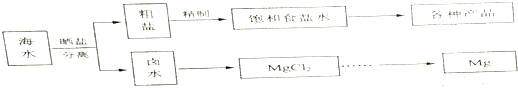
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.6 |
| Mg(OH)2 | 9.8 | 11.1 |
分析 (1)活泼金属的制取一般采取电解熔融盐的方法;由电解方程式可计算出氢氧根的浓度,进而算出PH;根据题给信息写出反应物和生成物,配平即得电解方程式;
(2)①将Fe(OH)2转化为Fe(OH)3而除去应加氧化剂,从图中可看出将Fe2+、Fe3+、Mn2+转化为沉淀除去,PH应为9.6-9.8,PH=9.8时Mg2+开始沉淀;
②金属发生电化学腐蚀,正极发生还原反应.
解答 解:(1)①因钠比较活泼,制取时只能采用电解的方法,方程式为:2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑,故答案为:2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑;
②电解饱和食盐水在阴极得到氢气,阳极得到氯气,氯气的物质的量为:$\frac{0.112L}{22.4L/mol}$=0.005mol;
由2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH 可知,Cl2↑~H2↑~2NaOH,则n(NaOH)=2n(Cl2)=2×0.005mol=0.01mol,c(NaOH)═0.1mol/L,所以pH=13,
故答案为:13;
③“84”消毒液为次氯酸钠溶液,电解氯化钠溶液制取次氯酸钠的方程式为:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑,故答案为:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;
(2)①将Fe(OH)2转化为Fe(OH)3而除去应加氧化剂,该物质为NaClO,从图中可看出将Fe2+、Fe3+、Mn2+转化为沉淀除去,PH最低应该为9.6,PH=9.8时Mg2+开始沉淀,所以PH值最大应小于9.8;
故答案为:NaClO;9.6≤PH<9.8;
②金属发生电化学腐蚀,正极发生还原反应,电极反应式为O2+4e-+2H2O═4OH-,故答案为:O2+4e-+2H2O═4OH-.
点评 本题考查较为综合,涉及物质分离提纯、电解等知识,题目综合度较高,难度较大,学习中注重相关基础知识的积累.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②④ | C. | ①②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
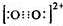 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用激光笔分别照射盛有牛奶、食盐水的玻璃杯,都有光亮的通路 | |
| B. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,转换材料是二氧化硅 | |
| C. | 氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 | |
| D. | 可以用物理方法或化学方法从海水中提取所需物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅②④⑤ | B. | 仅①③④ | C. | 仅①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
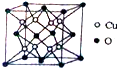 铜是应用广泛的有色金属.
铜是应用广泛的有色金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为+3价 | B. | 位于第IA族 | ||
| C. | 位于第三周期 | D. | 离子半径大于其原子半径 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com