
【题目】碳及其化合物有广泛的用途。
(1)反应C(s)+H2O(g)![]() CO(g)+H2(g)ΔH=+131.3kJmol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g)+H2(g)ΔH=+131.3kJmol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)![]() 2CO(g)△H=+172.5kJmol-1
2CO(g)△H=+172.5kJmol-1
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的△H= kJmol-1。
CO2(g)+H2(g)的△H= kJmol-1。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
t / min | 2 | 4 | 7 | 9 |
n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
①其它条件不变,降低温度,达到新平衡前v(逆)__________v(正)(填“>”、“<”或“=”) 。
②该温度下,此反应的平衡常数K= ;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、 “减小”或“不变”)。
【答案】(1)BC(2)-41.2
(3)CH3OH6e-+H2O=CO2+6H+(3分)
(4)①<(2分);②K=9/25或0.36(3分);③不变(2分)
【解析】
试题分析:(1)反应C(s)+H2O(g) ![]() CO(g)+H2(g)ΔH=+131.3kJmol-1是吸热反应,要提高氢气的产率,必须使平衡正向进行,C是固体,增大碳的用量,平衡不移动,A项错误;升高温度,或减小生成物CO的浓度,平衡正向移动,BC项正确;催化剂只能加快反应速率,不能改变平衡,D项错误,答案选BC;
CO(g)+H2(g)ΔH=+131.3kJmol-1是吸热反应,要提高氢气的产率,必须使平衡正向进行,C是固体,增大碳的用量,平衡不移动,A项错误;升高温度,或减小生成物CO的浓度,平衡正向移动,BC项正确;催化剂只能加快反应速率,不能改变平衡,D项错误,答案选BC;
(2)C(s)+H2O(g)![]() CO(g)+H2(g)ΔH=+131.3kJmol-1,①
CO(g)+H2(g)ΔH=+131.3kJmol-1,①
C(s)+CO2(g)![]() 2CO(g)△H=+172.5kJmol-1②
2CO(g)△H=+172.5kJmol-1②
根据盖斯定律反应CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
△H=①-②=+131.3kJmol-1-172.5kJmol-1=-41.2kJmol-1;
(3)燃料电池中负极发生氧化反应,所以燃料在负极发生氧化反应,结合电解质溶液,负极发生的反应是甲醇失去电子生成二氧化碳和氢离子,电极反应式为CH3OH 6e-+ H2O = CO2+6H+ ;
(4)①CO(g)+H2O(g)![]() CO2(g)+H2(g)是放热反应,所以降低温度平衡正向移动,则达到新平衡前反应正向进行,v(逆)< v(正);
CO2(g)+H2(g)是放热反应,所以降低温度平衡正向移动,则达到新平衡前反应正向进行,v(逆)< v(正);
②该温度下,达平衡时,H2O(g)和CO的浓度均是0.10mol/2.0L=0.05mol/L,CO2、H2的平衡浓度均是(0.16-0.10)mol/2.0L=0.03mol/L,此反应的平衡常数K=c(CO2)c(H2)/c(CO)c(H2O)=0.032/0.052=0.36;
③该反应是反应前后气体的物质的量不变的可逆反应,所以其它条件不变,再充入0.1mol CO和0.1mol H2O(g),达到的新平衡与原平衡等效,平衡时CO的体积分数不变。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。 (夹持装置和A中加热装置已略,气密性已检验)。
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2==HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
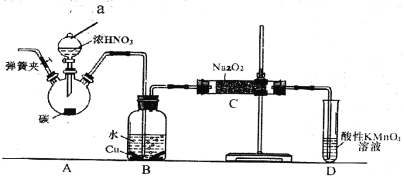
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
回答下列问题:
(1)装置中仪器a的名称为___________;D装置的作用是_______________。
(2)A中反应的化学方程式是___________________,C中反应生成NaNO2的化学方程式是____________。
(3)检验C中产物有亚硝酸钠的正确操作是__________
a.取少量生成物溶于水充分振荡,滴加酚酞试液,若溶液变红,则含有NaNO2。
b.取少量生成物溶于稀硫酸,若产生无色气体并在液体上方变为红棕色,则含有NaNO2。
(4)经检验C产物中亚硝酸钠含量较少。
①甲同学认为C中产物不仅有亚硝酸钠,还可能有其它固体物质。为排除干扰,甲在B、C装置间增加装置E,E中盛放的试剂应是________(写名称).
②乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是______________。
(5)NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg。从1000g隔夜熟肉, 中提取NaNO3和NaNO2后,配成溶液,再用0.00500mol/L的高锰酸钾(酸性)溶液滴定,消耗高锰酸钾溶液16.00mL,由此计算隔夜熟肉中NaNO2的含量是________mg/kg 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水汽化; ②胆矾加热变为白色粉末;③浓硫酸稀释;
④氯酸钾分解制氧气;⑤碳与氧气反应生成一氧化碳。
A.①③⑤ B.②④ C.①② D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。请回答下列问题。
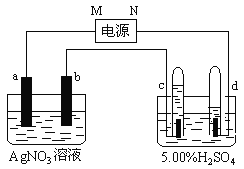
(1)直流电源中,N为 极。
(2)AgNO3溶液的浓度___________(填增大、减小或不变。下同),H2SO4溶液的pH ,若要硫酸恢复成原溶液需加入
(3)Pt电极上生成的物质是 ,其质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式: .若1g水蒸气转化成液态水放热2.5kJ,则氢气的燃烧热为△H= kJ/mol.
(2)近年来已经研制出甲烷(CH4)燃料电池,该电池的电解质溶液为H2SO4溶液,写出该电池负极的电极反应式: .该电池总反应式: .
(3)用惰性电极电解AgNO3溶液,写出该电解反应的化学方程式 ;若在阳极收集到 0.32g O2,中和电解生成的酸需0.4molL﹣1NaOH溶液 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组准备用如下图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
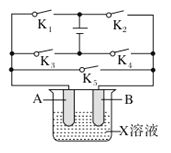
A电极 | B电极 | X溶液 | |
甲 | Cu | Zn | H2SO4 |
乙 | Pt | Pt | CuCl2 |
丙 | Fe | Cu | ? |
(1)甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为______________。
(2)乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为___________________。实验时应闭合的电键的组合是________(从下列五项中选择所有可能组合,第(3)小题也在这五项中选择)。
A.K1和K2
B.K1和K3
C.K1和K4
D.K2和K3
E.K2和K4
(3)丙同学准备在Fe上镀Cu,选择了用某种盐来配制电镀液,则该盐中应含的阳离子为________,实验时,应闭合的电键的组合是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年9月15日22时04分12秒,天宫二号空间实验室在酒泉卫星发射中心发射成功。2016年10月19日凌晨,神舟十一号飞船与天宫二号自动交会对接成功。天宫上的太阳能电池板的半导体材料是
A. 硅 B. 二氧化硅 C. 铝硅合金 D. 铜硅合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液、胶体和浊液这三种分散系的本质区别是( )
A. 是否为大量分子和离子的集合体
B. 分散质粒子的大小
C. 能否通过滤纸或半透膜
D. 是否均一、稳定、透明
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com