
| A. | 石墨、醋酸溶液、食盐晶体 | B. | 熔融状态的KOH、熔融状态的NaCl | ||
| C. | 稀H2SO4、NaOH溶液、纯HNO3 | D. | 液氨、石灰水、水银 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,能导电的物质中含有自由电子或自由移动的阴阳离子,水溶液中或熔融状态完全电离的电解质为强电解质.
解答 解:A、石墨能导电是单质不是电解质,醋酸溶液能导电是乙酸和水的混合物,其中醋酸属于弱电解质,食盐晶体是电解质但不导电,故A错误;
B、熔融NaCl、熔融KH,属于强电解质能导电,故B正确;
C、稀硫酸和NaOH溶液是混合物,不是电解质,纯硝酸不导电,故C错误;
D、液氨、石灰水是混合物,水银是单质,都不是电解质,故D错误;
故选B.
点评 本题考查了电解质和非电解质的判断,注意电解质不一定导电,导电的不一定是电解质,强电解质完全电离,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | FexO溶于足量盐酸后只生成了FeCl3和H2O | |
| B. | 标准状况下112 mL Cl2的物质的量是5 mol | |
| C. | x=0.8 | |
| D. | 通入Cl2后,发生反应的离子方程式:Fe2++Cl2=Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强(标准大气压) | 1 | 5 | 10 | 100 |
| SO2转化率(%) | 93.5 | 96.9 | 97.8 | 99.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
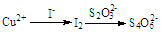
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
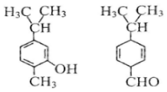
| A. | 不是同分异构体 | |
| B. | 分子中共平面的碳原了数相同 | |
| C. | 含氧官能团的性质不同 | |
| D. | 可用红外光谱区分,但不能用核磁共振氢谱区分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,可用来干燥H2S | B. | 浓硫酸在常温下不与铁和铝反应 | ||
| C. | 可将蒸馏水注入浓硫酸进行稀释 | D. | 棉花接触浓硫酸后会变黑 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
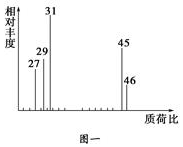
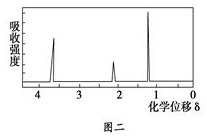
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com