
| A. | FeO+CO═Fe+CO2 △H=-11kJ•mol-1 | |
| B. | FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-22kJ•mol-1 | |
| C. | FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ•mol-1 | |
| D. | FeO(s)+CO(g)═Fe(s)+CO2(g))△H=11kJ•mol-1 |
分析 根据盖斯定律,按照目标反应方程式FeO(s)+CO(g)═Fe(s)+CO2(g)的特点,将三个化学方程式进行加减乘除的变化,从而得到目标反应,反应热做相应的变化即可.
解答 解:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol ①
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol ③
由①×3-②-③×2得
6CO(g)+6FeO(s)=6Fe(s)+6CO2(g)△H=(-25kJ/mol)×3-(-47kJ/mol)-(+19kJ/mol)×2=-66kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-11kJ/mol
故选C.
点评 本题考了热化学方程式的书写和应用查盖斯定律进行反应热的计算,热化学方程式的书写,容易出错,题目有一定的难度.


科目:高中化学 来源: 题型:选择题
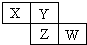 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氢化物能与其最高价氧化物对应的水化物反应生成盐 | |
| B. | 原子半径:X<Y | |
| C. | Z的非金属性比Y的强 | |
| D. | X与Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
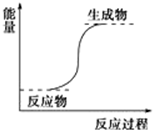
| A. | 氢氧化钡晶体和氯化铵晶体的反应 | |
| B. | 能量变化如图所示的反应 | |
| C. | 化学键断裂吸收的能量比化学键形成放出的能量少的反应 | |
| D. | 不需要加热就能发生的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
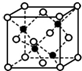 前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.
前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质燃烧一定是放热反应 | |
| B. | 断开反应物中的化学键要放出能量 | |
| C. | 放热的化学反应不需要加热都能发生 | |
| D. | 化学反应除了生成新的物质外,还伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入金属镁产生H2的溶液中:NH4+、Na+、SO42-、CH3COO- | |
| B. | 含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- | |
| C. | c(Cu2+)=0.1 mol•L-1的溶液中:H+、NH4+、Br-、CO32- | |
| D. | 含有大量MnO4-的溶液中:H+、SO42-、Cl-、CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
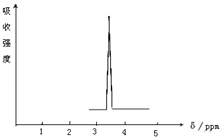 (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是AD.
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是AD.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com