
| ������ | K+��NH4+��Fe3+��Ba2+ |
| ������ | Cl-��Br-��CO32-��HCO3-��SO32-��SO42- |

���� ����Һ���Ȼ�����Һ��Ӧ�õ�����A������Һ�п��ܺ���CO32-��SO32-��SO42-��������м���ϡ�����������壬���в��ֳ������ܽ⣬����Һ�д���CO32-�����ܴ���SO32-��SO42-�е����ֻ�һ�֣��������ӹ���֪����Һ�в�����Ba2+��
��ҺA����Ba2+�����������NaOH��Һ�õ�����B����ɫ����B������Һ��һ������NH4+��HCO3-��һ��������Fe3+������BΪNH3����ɫ����BΪBaCO3����ҺB��ͨ����������dz����ɫ��Һ����Һ��һ��û��Br-����ҺB�м�����������������Һ�õ���ɫ����C��CΪAgCl��˵����ҺB�к���Cl-�����ڼ����Ȼ�����Һ������ȷ��ԭ��Һ���Ƿ���Cl-��
����ɫ����D�ǵ�һ���壬��DΪCO2��EΪCaCO3����Һ�к���CO32-����ɫ����Dֻ��ΪBaSO4����Һ��һ��û��SO32-��һ������SO42-���Դ˽����⣮
��� �⣺��1�������Ϸ�����֪����BΪNH3����ɫ����EΪCaCO3���ʴ�Ϊ��NH3��CaCO3��
��2�������Ϸ�����֪һ������HCO3-��CO32-��SO42-���ʴ�Ϊ��HCO3-��CO32-��SO42-��
��3��������������֪����ɫ����BΪ̼�ᱵ������HCO3-��Ba2+��OH-��Ӧ���ɣ���Ӧ���ӷ���ʽΪ��HCO3-+Ba2++OH-=BaCO3��+H2O��
�ʴ�Ϊ��HCO3-+Ba2++OH-=BaCO3��+H2O��
��4��������������֪������ȷ��ԭ��Һ���Ƿ���Cl-����Һ��һ��û��Br-��
����ɫ����D�ǵ�һ���壬��DΪCO2��EΪCaCO3����Һ�к���CO32-����ɫ����Dֻ��ΪBaSO4����Һ��һ��û��SO32-��һ������SO42-��
B��̼�ᱵ�������ʵ���=$\frac{19.7g}{197g/mol}$=0.1mol����n��HCO3-��=0.1mol����c��HCO3-��=$\frac{0.1mol}{1L}$=0.1mol/L��
E��̼��ƣ������ʵ���=$\frac{10g}{100g/mol}$=0.1mol����n��CO32-��=0.1mol����c��CO32-��=$\frac{0.1mol}{1L}$=0.1mol/L��
D�����ᱵ�������ʵ���=$\frac{11.65g}{233g/mol}$=0.05mol����n��SO42-��=0.05mol����c��SO42-��=$\frac{0.05mol}{1L}$=0.05mol/L��
n��NH4+��=n��NH3��=$\frac{2.24L}{22.4L/mol}$=0.1mol����c��NH4+��=0.1mol/L����Һ��c��Na+��=0.2mol/L��c��HCO3-��=0.1mol/L��c��CO32-��=0.1mol/L��c��SO42-��=0.05mol/L����λ���Ϊ�����=1��0.1mol/L+1��0.2mol/L=0.3mol/L����λ����ڸ����=1��0.1mol/L+2��0.1mol/L+2��0.05mol/L=0.4mol/L����λ���Ϊ����ɣ���λ����ڸ���ɣ���һ������K+������Һ��û��Cl-��K+����Ũ����С�����ݵ���غ��֪��c��K+����СŨ��=0.4mol/L-0.3mol��L=0.1mol/L��
�ʴ�Ϊ�����ڣ��ɵ���غ��֪K+������СŨ��Ϊ0.1mol/L��
���� ���⿼��������ƶϣ�Ϊ��Ƶ���㣬��������֮��ķ�Ӧ�������ƶ�����Ϊ���Ĺؼ������ط������ƶ������Ŀ��飬ע�����غ㼰Ԫ�ػ�����֪ʶ��Ӧ�ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���ݼ���ʽ�ش��������⣺
���ݼ���ʽ�ش��������⣺ ����ʽ��C5H8O2���ṹ��ʽ��CH2=C��CH3��COOCH3��
����ʽ��C5H8O2���ṹ��ʽ��CH2=C��CH3��COOCH3�� �����������4��̼ԭ�ӹ�ֱ�ߣ������20��ԭ�ӹ�ƽ�森
�����������4��̼ԭ�ӹ�ֱ�ߣ������20��ԭ�ӹ�ƽ�森 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ� | B�� | �� | C�� | ���ȼ��� | D�� | ���Ȼ�̼ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 =CH-C��C-CF3�д���ͬһƽ���ڵ�ԭ���������ǣ�������
=CH-C��C-CF3�д���ͬһƽ���ڵ�ԭ���������ǣ�������| A�� | 12�� | B�� | 14�� | C�� | 18�� | D�� | 20�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ʵ����� FeBr2��FeI2����Һ�л���ͨ��������I-��Fe2+��Br- | |
| B�� | �����ʵ����� Fe2+��Ag+��Cu2+��H+����Һ�л�������п�ۣ�Ag+��Cu2+��Fe2+��H+ | |
| C�� | �ں������ʵ����� Ba��OH��2��KOH �Ļ����Һ�л���ͨ�� CO2��Ba��OH��2��KOH��BaCO3��K2CO3 | |
| D�� | �ں������ʵ����� AlO2-��OH-��CO32-����Һ����μ������AlO2-��Al��OH��3��OH-��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na�ĺ����������Ǽ��������� | |
| B�� | �Ӻ�ˮ����ȡ������Ԫ�صĵ��ʵĹ��̶��漰������ԭ��Ӧ | |
| C�� | ������Ԫ���Ի���̬����ʱ�γɵĻ�ѧ��ֻ�����Ӽ� | |
| D�� | ��������NaCl��MgCl2��Һʱ���Եõ�����NaCl��MgCl2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��0.10mol•L-1NH4HCO3����Һ��ͨ��CO2��c��NH4+��=c��HCO3-��+c��CO32-�� | |
| B�� | ��0.10 mol•L-1NaHSO3����Һ��ͨ��NH3��c��Na+����c��SO32-����c��NH4+�� | |
| C�� | 0.10 mol•L-1Na2SO3����Һ��ͨ��SO2��c��Na+��=2[c��SO32-��+c��HSO3-��+c��H2SO3��] | |
| D�� | 0.10 mol•L-1CH3COONa����Һ��ͨ��HCl��c��Na+����c��CH3COOH��=c��Cl-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
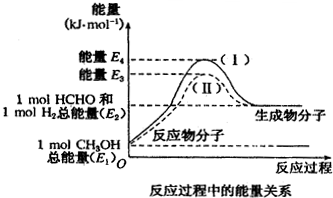
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com