
| A、所含质子数相等 |
| B、气体密度相等 |
| C、所含原子数相等 |
| D、摩尔质量相等 |
| M |
| Vm |
| M |
| Vm |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用稀硝酸清洗做过银镜反应的试管 |
| B、用稀盐酸清洗做高锰酸钾分解实验的试管 |
| C、用氢氧化钠溶液清洗盛过硅酸的试管 |
| D、用四氯化碳清洗做过碘升华的烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应产物的总能量大于反应物的总能量时,△H<0 |
| B、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
| C、△H<0、△S>0的反应在温度低时不能自发进行 |
| D、一个化学反应的△H仅与反应的起始状态和反应的最终状态有关,与反应途径无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
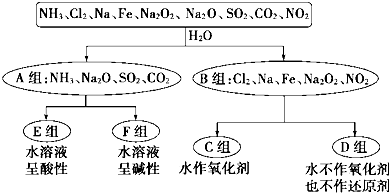
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中,加入过量的2mol?L-1盐酸,再滴加适量1mol?L-1 BaCl2溶液. | 有白色沉淀生成,证明待测溶液中含SO42- |
| 步骤② | ||
| 步骤③ |
查看答案和解析>>
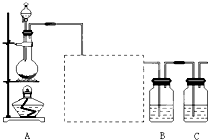
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com