
| A. | 熔点:庚烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 含氢量:甲烷>乙烯>乙炔>苯 | |
| C. | 密度:CCl4>CHCl3>苯>H2O | |
| D. | 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
分析 A.烷烃都是分子晶体,分子晶体熔沸点与相对分子质量成正比,所以烷烃的熔沸点随着碳原子个数增大而增大;
B.根据C、H原子数目之比判断含氢量;
C.烃的密度小于水,多氯代烃的密度大于水,且氯原子越多,密度越大;
D.苯甲酸改写为C6H6.CO2,与等物质的量的苯耗氧量相等,环己烷、己烷、苯均含有6个碳原子,含有H原子数目越大,消耗氧气越多.
解答 解:A.烷烃都是分子晶体,分子晶体熔沸点与相对分子质量成正比,所以烷烃的熔沸点随着碳原子个数增大而增大,所以熔沸点庚烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷,故A正确;
B.甲烷、乙烯、乙炔、苯中C、H原子数目之比分别为1:4、1:2、1:1、1:1,故含氢量:甲烷>乙烯>乙炔=苯,故B错误;
C.苯的密度小于水,CCl4、CHCl3的密度大于水,且氯原子越多,密度越大,故密度:CCl4>CHCl3>H2O>苯,故C错误;
D.苯甲酸改写为C6H6.CO2,与等物质的量的苯耗氧量相等,环己烷、己烷、苯均含有6个碳原子,含有H原子数目:己烷>环己烷>苯,三种物质的量相等,含有H原子数目越大,消耗氧气越多,故同物质的量物质燃烧耗O2量:己烷>环己烷>苯=苯甲酸,故D错误,
故选A.
点评 本题考查熔沸点高低判断、密度大小判断及方程式的有关计算,明确熔沸点、密度大小比较方法是解本题关键,难点是D选项,注意苯甲酸的计算技巧,题目难度中等.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
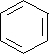 .
. .
.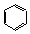 ;CH2=CH2和
;CH2=CH2和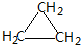 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
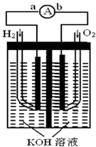 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器里的压强不随时间的变化而改变 | |
| B. | 单位时间内生成2mol HBr的同时,消耗1 mol H2 | |
| C. | 单位时间内生成2mol HBr的同时,生成1 mol H2 | |
| D. | 正反应和逆反应速率都相等,都等于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
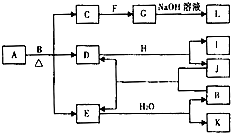 由两种元素组成的化合物A存在如图所示的转化关系(部分产物及反应条件已略去).已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质.L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G.试回答下列问题:
由两种元素组成的化合物A存在如图所示的转化关系(部分产物及反应条件已略去).已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质.L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③⑤ | C. | ②④ | D. | ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com