
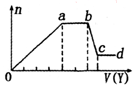
 某无色稀溶液X中,可能含有如表所列离子中的某几种.取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示.下列说法正确的是( )
某无色稀溶液X中,可能含有如表所列离子中的某几种.取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(y)的关系如图所示.下列说法正确的是( )| 阴离子 | CO32-、SiO32-、[Al(OH)4]-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则X中一定含有CO32-、SiO32-、[Al(OH)4]-和NH4+ | |
| B. | 若Y是NaOH溶液,则X中一定含有A13+、Fe3+、NH4+、Cl- | |
| C. | 若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-═NH3↑+H2O | |
| D. | 若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为2:1:4 |
分析 溶液无色说明溶液中不含Fe3+;
(1)如果Y是盐酸,向溶液中加盐酸,先生成沉淀,则溶液中可能含SiO32-、[Al(OH)4]-或两者中的一种,即生成的沉淀为H2SiO3、Al(OH)3或两者中的一种,则溶液中不含Al3+、Mg2+;当a-b段时,沉淀的量不变化,发生的是盐酸和碳酸根离子反应生成气体;当b-c段时沉淀的质量减少,即部分沉淀和盐酸反应,部分沉淀和盐酸不反应,说明生成的沉淀既有H2SiO3又有Al(OH)3,原溶液中有硅酸根离子和[Al(OH)4]-离子,弱酸根离子和铵根离子能双水解,所以溶液中不含NH4+,含有的阳离子是Na+;
(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,当a-b段时,沉淀的量不变化,氢氧化钠和铵根离子反应生成气体;当b-c段时沉淀的质量减少,部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有铝根离子和镁离子,则溶液中不含硅酸根离子、碳酸根离子和[Al(OH)4]-离子,所以溶液中含有的阴离子是氯离子.
解答 解:溶液无色说明溶液中不含Fe3+;
(1)如果Y是盐酸,向溶液中加盐酸,先生成沉淀,则溶液中可能含SiO32-、[Al(OH)4]-或两者中的一种,即生成的沉淀为H2SiO3、Al(OH)3或两者中的一种,则溶液中不含Al3+、Mg2+;当a-b段时,沉淀的量不变化,发生的是盐酸和碳酸根离子反应生成气体:CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑;当b-c段时沉淀的质量减少,即部分沉淀和盐酸反应:Al(OH)3+3H+═Al3++3H2O,部分沉淀和盐酸不反应,说明生成的沉淀既有H2SiO3又有Al(OH)3,原溶液中有SiO32-和[Al(OH)4]-,则oa段发生反应的离子方程式SiO32-+2H+═H2SiO3↓,[Al(OH)4]-+H+═Al(OH)3↓+H2O,由于SiO32-和[Al(OH)4]-和铵根离子能双水解,所以溶液中不含NH4+,含有的阳离子是Na+.
则X中一定含有的离子是CO32-、SiO32-、AlO2-、Na+,oa段发生反应的离子方程式SiO32-+2H+═H2SiO3↓,[Al(OH)4]-+H+═Al(OH)3↓+H2O,ab段发生反应的离子方程式CO32-+H+═HCO3-,HCO3-+H+═H2O+CO2↑,bc段发生反应的离子方程式:Al(OH)3+3H+═Al3++3H2O.
综上可知含有的离子为:CO32-、SiO32-、AlO2-、Na+;
(2)若Y是氢氧化钠,向溶液中加氢氧化钠溶液,先生成沉淀,溶液中可能含Al3+、Mg2+或两者中的一种,由于弱碱阳离子和弱酸根会双水解而不能共存,即溶液中不含CO32-、SiO32-、[Al(OH)4]-,由于溶液一定要保持电中性,故溶液中一定含Cl-;当a-b段时,沉淀的量不变化,是氢氧化钠和铵根离子反应生成气体:NH4++OH-═NH3•H2O,即溶液中含NH4+;当b-c段时沉淀的质量减少但没有完全溶解,即部分沉淀和氢氧化钠反应,部分沉淀不反应,说明溶液中有Al3+、Mg2+,即bc段的反应为:Al(OH)3+OH-═AlO2-+2H2O.
综上可知,X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-;
A.由分析可知,若Y是盐酸,则X中一定含有:CO32-、SiO32-、AlO2-、Na+,故A错误;
B.若Y是氢氧化钠,X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,没有Fe3+,故B错误;
C.若Y是NaOH溶液,当a-b段时,沉淀的量不变化,是氢氧化钠和铵根离子反应生成气体:NH4++OH-═NH3•H2O,故C错误;
D.与铵根离子反应需要氢氧化钠的体积是2v,氢氧化铝和氢氧化钠反应需要氢氧化钠的体积是1v,则生成氢氧化铝需要氢氧化钠的体积是3V,生成氢氧化镁需要氢氧化钠的体积是1V,则n(Al3+):n(Mg2+):n(NH4+)=1:$\frac{1}{2}$:2=2:1:4,故D正确.
故选D.
点评 本题考查离子检验及离子反应,根据溶液的颜色结合题给图象确定溶液中存在的离子,再结合物质之间的反应来确定微粒的量,同时考查学生思维的缜密性、考虑问题的全面性,题目较难.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molN2所含有的原子数为NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | Na2O2和CO2的反应中,每有1molNa2O2参加反应转移电子数为2NA | |
| D. | 16 gO2分子和16 gO3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C与14C为不同核素 | B. | 石墨和C60互为同素异形体 | ||
| C. | H2O和D2O互为同位素 | D. | ${\;}_{17}^{35}$X与${\;}_{17}^{37}$Y 为同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  利用图所示装置检验溴乙烷发生消去反应,生成乙烯 | |
| B. |  利用图所示装置配置银氨溶液 | |
| C. | 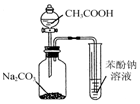 利用图所示装置证明H2CO3酸性强于苯酚 | |
| D. | 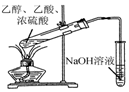 利用图所示装置制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类 | |
| B. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 | |
| C. | 根据分散剂粒子的大小,将分散系分为溶液、浊液和胶体 | |
| D. | 根据纯净物的元素组成,将纯净物分为单质和化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com