
【题目】实验室用KClO3分解(MnO2做催化剂)制取氧气,实验后回收剩余固体中的MnO2,正确的操作步骤是
A. 溶解、过滤、蒸发 B. 溶解、过滤、洗涤、干燥
C. 溶解、过滤、结晶 D. 溶解、结晶、干燥
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关.
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:____min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②3~4min内以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积.他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量.你认为不可行的是____(填字母)。
A 蒸馏水 B KCl洛液 C 浓盐酸 D CuSO4溶液
(3)在4L密闭容器中,X、Y、Z三种气体的物质的量随时间变化曲线如图。
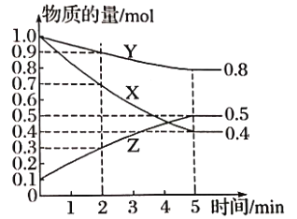
①该反应的化学方程式是_______________。
②该反应达到平衡状态的标志是___________(填字母)。
A Y的体积分数在混合气体中保持不变 B X,、Y的反应速率比为3:1
C 容器内气体压强保持不变 D 容器内气体的总质量保持不变
E 生成1molY的同时消耗2molZ
③2min内Y的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空
Ⅰ.已知:① 2C3H8(g) + 7O2(g) ===6CO(g) + 8H2O(l) ΔH=-2741.8 kJ/mol
② 2CO(g) + O2(g) ===2CO2(g) ΔH=-566 kJ/mol
(1)反应C3H8(g) + 5O2(g) ===3CO2(g) + 4H2O(l)的ΔH=______________
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH>0
CO2(g) + H2(g) ΔH>0
① 下列事实能说明该反应达到平衡的是___________(填序号)
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② 在某温度下,反应物的起始浓度分别为:c(CO)=1 mol/L, c(H2O)=2.4 mol/L; 达到平衡后,CO的转化率为60%,该反应在此温度下的平衡常数是___________
(3)熔融碳酸盐燃料电池的电解质为Li2CO3和 Na2CO3的混合物,燃料为CO,在工作过程中,电解质熔融液的组成、浓度都不变,写出负极发生的电极反应式___________________________。
Ⅱ.某二元酸(H2A)在水中的电离方程式是:H2A=== H++HA-HA-![]() H++A2-
H++A2-
(1)Na2A溶液显________(填“酸性”、“中性”或“碱性”)。理由是(用离子方程式表示)____________ ;在Na2A溶液中c(Na+)=_______。
(2)已知0.1 mol/LNaHA溶液的pH=2,则0.1 mol/L H2A溶液中氢离子的物质的量浓度应______0.11 mol/L(填“<”、“>”或“=”),理由_____________________________
(3)实验室中常用NaOH溶液来进行洗气和提纯,当100mL 3mol/L的NaOH溶液吸收标准状况下4.48L CO2时,所得溶液中各离子浓度由大到小的顺序为________________
(4)常温下向一定体积的0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是_________。
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中![]() 不变
不变
D.溶液中![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如下图所示。
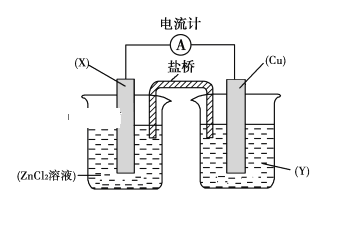
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________。
(2)铜电极为电池的________极,发生的电极反应为______________________,X极上发生的电极反应为________________。
(3)外电路中的电子是从________极流向________极。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置测定中和热的实验步骤如下:
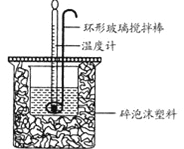
①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度,回答下列问题:
(1)为什么所用NaOH溶液要稍过量?_________
(2)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol·L-1的稀盐酸恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3的大小关系为________。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,相关示意图像错误的是
A | B | C | D |
将二氧化硫通入到 一定量氯水中 | 将氨水滴入到一定量氯化铝溶液中 | 将铜粉加入到一定量 浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态有机物X含C、H、O三种元素,已知下列条件,现欲确定X的分子式,所需最少条件是 ( )
①X中含碳质量分数 ②X中含氢质量分数③X在标准状况下的体积 ④X对H2的相对密度⑤X的质量
A.①②B.①②④
C.①②⑤D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:
2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
(1)在密闭容器中充入NH3和CO2 ,一定条件能自发进行的原因是__________________;
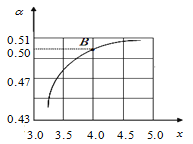
(2)T1℃时,在2 L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是_________________;
=x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是_________________;
(3)当x=2,上述反应至5min时各物质的浓不再发生变化,若起始的压强为P0 KPa,测得平衡体系压强变为起始时的![]() 。反应结束后,分离得到90g尿素。
。反应结束后,分离得到90g尿素。
试计算该反应的平均速率v(CO2)=___________________,
该反应的平衡常数(K)=________________,
达到平衡后NH3的物质的量浓度为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com