
(10分) 高炉炼铁过程中发生的主要反应为 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=____________,ΔH______0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃ 时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=__________________、CO的平衡转化率=__________;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是__________。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
(1)c(CO2) / c(CO) <(2)0.006mol/(L·min) 60﹪(3)C
【解析】
试题分析:(1)固体的浓度看成是一个常数,不写在平衡常数表达式中,故K=c(CO2) / c(CO),根据表格给出的数据知道温度升高K减小,说明温度升高平衡向逆向移动,逆反应方向就是吸热反应,那么正反应就是放热反应,ΔH < 0(2)先比较浓度商和平衡常数的关系Q=c(CO2) / c(CO)=0.1 mol/L /0.1 mol/L =1 <K=4.0,所以反应向正向进行,设CO浓度变化了x,有:
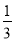 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
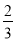 Fe(s)+CO2(g)
Fe(s)+CO2(g)
起始浓度(mol/L) 0. 1 0. 1
变化浓度(mol/L) x x
平衡浓度(mol/L) 0.1-x 0.1+x (1+x)/(1-x)=4.0 得x=0.06 mol/L, v(CO2)=0.06 mol/L÷10min=0.006mol/(L·min),CO的平衡转化率=0.06 mol/L÷0.1mol/L=0.6=60﹪(3)要提高CO的转化率,就要让平衡向正向移动, Fe和Fe2O3 都是固体,改变它们的量对反应体系的浓度没有影响,故平衡不发生移动,A、B 不可行; 移出部分CO2,使生成物的浓度减小,平衡向正向移动,C对;反应时放热反应,提高反应温度平衡向逆向移动,D错;减小容器的容积,增大压强,但反应两边气体的化学计量数相等,平衡不移动,E错;催化剂不能让平衡发生移动,F错,选C。
考点:平衡常数和转化率的计算、化学平衡的移动。


科目:高中化学 来源:2014-2015河北省高一12月月考化学试卷(解析版) 题型:选择题
下列物质性质的比较叙述正确的是
A.在水中溶解性:Na2CO3<NaHCO3
B.热稳定性:Na2CO3>NaHCO3
C.同浓度溶液与足量酸反应的速度:Na2CO3>NaHCO3
D.将固体溶于少量水放出的热量:Na2CO3<NaHCO3
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一上学期第三次月考化学试卷(解析版) 题型:实验题
(10分)某同学帮助水质检测站配制800mL 1 mol·L-1NaOH溶液备用。
(1)该同学应选择的玻璃仪器除了烧杯、量筒、玻璃棒、胶头滴管外,还有 。

(2)其操作步骤如下图所示,则如图操作应在下图中的 (填选项字母)之间。
A.②与③ B.①与② C.④与⑤ D.③与④
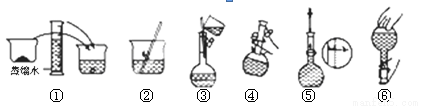
(3)该同学应用托盘天平称取NaOH固体 g,用质量为33.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在下图中选出能正确表示游码位置的选项 (填选项字母)。

(4)下列操作对所配溶液浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,仰视读数,浓度会 ;
②转移溶液过程中,未洗涤玻璃棒和烧杯,浓度会 ;
③容量瓶未干燥,浓度会 ;
④定容摇匀后发现溶液凹面低于刻度线,继续加水至刻度线,浓度会 。
(5)配制溶液的实际操作过程中,动作要快,否则由于 ,会使配制的NaOH溶液的浓度比1 mol·L-1 ______(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一上学期第三次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,1 mol CO2和CO的混合气中含有的氧原子数为1.5NA
B.常温常压下,33.6 L 氯化氢气体中含有的分子数为1.5NA
C.12g Mg与足量二氧化碳反应转移的电子数为NA
D.1 mol·L-1 CuCl2溶液中含有的氯离子数为2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列物质中,属于能导电的电解质的是
A.无水酒精 B.熔融的氯化钠 C.纯铝导线 D.氢氧化钠晶体
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:选择题
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是

A.a 为电源的正极
B.通电一段时间后,石墨电极附近溶液先变红
C.Fe电极的电极反应是4OH-- 4e-=2H2O+O2↑
D.电解饱和食盐水的总反应是: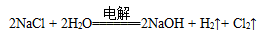
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:选择题
下列各电离方程式中,书写正确的是
A.CH3COOH === H++CH3COO- B.KHSO4  K++H++SO42-
K++H++SO42-
C.Al(OH)3 Al3++3OH- D.NaH2PO4
Al3++3OH- D.NaH2PO4  Na++H2PO4-
Na++H2PO4-
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省乐清市高二上学期10月月考化学试卷(解析版) 题型:选择题
下列关于判断过程的方向的说法正确的是
A.所有自发进行的化学反应都是放热反应
B.判断化学反应能否自发进行,必须综合考虑反应的焓变和熵变
C.自发反应一定是熵增大,非自发反应一定是熵减小的反应
D.同一物质的固、液、气三种状态中固体的熵值最大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:选择题
下列关于0.10 mol/L NaHCO3溶液的说法正确的是
A.溶质的电离方程式为:NaHCO3→Na++H++CO32-
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3- )+c(CO32-)
D.温度升高,c(HCO3- )增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com