
| A. | O2和O3 | B. | C2H6和C3H8 | ||
| C. | 葡萄糖和蔗糖 | D. | CH3CH2OH和CH3OCH3 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4+Ba(OH)2=BaSO4↓+2H2O | B. | HCl+NaOH=NaCl+H2O | ||
| C. | NaOH+CH3COOH=CH3COONa+H2O | D. | Cu(OH)2+2HCl=CuCl2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
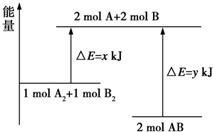
| A. | 该反应过程吸收能量 | |
| B. | 断裂 1molA-A 键和 1molB-B 键可放出 x kJ 能量 | |
| C. | 形成 2molA-B 键需要放出 y kJ 能量 | |
| D. | 2molAB 的总能量高于 1molA2和 1molB2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
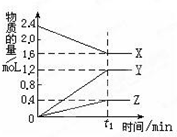 某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.
某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
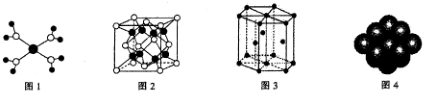
| A. | 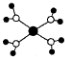 水合铜离子的模型如图所示,1个水合铜离子中含有4个配位键 | |
| B. | 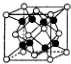 K2O晶体的晶胞如图所示,每个K2O晶胞平均占有8个O2- | |
| C. | 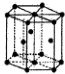 金属Zn中Zn原子堆积模型如图所示,空间利用率为68% | |
| D. |  金属Cu中Cu原子堆积模型如图,为面心立方最密堆积,每个Cu原子的配位数均为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③CH3CH2Cl ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2Cl ④CH3COOH ⑤聚乙烯五种物质中:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com