
 .
.分析 (1)得电子被还原,双氧水是共价化合物,氧原子和氧原子间存在非极性共价键,氢原子和氧原子间存在极性共价键;
(2)H2O2与KI作用时,KI参加了化学反应,但反应前后其性质和质量均无改变.
解答 解:(1)该反应中硝酸根离子得电子发生还原反应,所以是还原过程,双氧水的电子式为 ,
,
故答案为:还原; ;
;
(2)双氧水和水是弱电解质,碘化钾、次碘酸钾都是强电解质,所以其离子方程式为H2O2+I-═IO-+H2O,H2O2与KI作用时,KI参加了化学反应,但反应前后其性质和质量均无改变,因此它实际是催化剂,对H2O2的分解起催化作用,将方程式③×2+④得2H2O2═2H2O+O2↑,
故答案为:H2O2+I-═IO-+H2O;催化作用;2H2O2═2H2O+O2↑.
点评 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,离子方程式的书写是学习难点,注意KI作用的判断方法,难度中等.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是
A.Ag和AgCl溶液 B.Ag和AgNO3溶液 C.Pt和Ag2CO3溶液 D.Pt和Ag2SO4溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
下列每组的物理量,不能求物质的量的是( )
① | ② | ③ | ④ | ⑤ |
物质的粒子数 | 标准状况下气体摩尔体积 | 固体体积 | 溶质的质量分数 | 非标准状况物质的质量 |
阿伏加德罗常数 | 标准状况气体体积 | 固体密度 | 溶液的体积 | 物质的摩尔质量 |
A.①③ B.③④ C.②③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向20mL 0.2mol/L二元酸H2A溶液中滴加0.2mol/LNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )
常温下,向20mL 0.2mol/L二元酸H2A溶液中滴加0.2mol/LNaOH溶液,有关微粒物质的量变化如图.下列叙述正确的是( )| A. | 从图象中可知H2A为强酸 | |
| B. | 当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)>c( A2-)>c(OH-) | |
| C. | 当V(NaOH)=20 mL时混合溶液的pH值大于7 | |
| D. | 当V(NaOH)=40 mL时,升高温度,c(Na+)/c(A2-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.0 | B. | 9.5 | C. | 10.5 | D. | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯(
乙苯(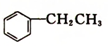 )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途. (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1| 化学键 | C-H | C-C | C=C | C-Cl | H-Cl |
| 键能/(kJ•mol-1) | 412 | 348 | X | 341 | 432 |
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4 (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com