
·ÖĪö £Ø1£©øł¾ŻN=nNA”¢M=$\frac{m}{n}$¼ĘĖć£»
£Ø2£©ÓÉn=$\frac{m}{M}$”¢N=nNAæÉÖŖ£¬ÖŹĮæĻąµČŹ±M×ī“óµÄ·Ö×ÓŹż×īÉŁ£¬½įŗĻ·Ö×Ó×é³ÉÅŠ¶ĻŌ×ÓŹż£»ÓÉV=nVm”¢¦Ń=$\frac{M}{{V}_{m}}$æÉÖŖ£¬ĻąĶ¬ĪĀ¶ČŗĶĻąĶ¬Ń¹ĒæĢõ¼ž£¬n“óµÄĢå»ż¾Ķ“ó£¬M“óµÄĆÜ¶Č¾Ķ“ó£¬ŅŌ“ĖĄ“½ā“š£»
£Ø3£©ĻČ¼ĘĖćÅØĮņĖįµÄĪļÖŹµÄĮæÅØ¶Č£¬ŌŁøł¾ŻČÜŅŗĻ”ŹĶĒ°ŗóČÜÖŹµÄĪļÖŹµÄĮæ²»±ä¼ĘĖćĖłŠčÅØŃĪĖįµÄĢå»ż£®
½ā“š ½ā£ŗ£Ø1£©3.01”Į1023øö·Ö×ÓAµÄĪļÖŹµÄĮæĪŖ£ŗn=$\frac{3.01”Į1{0}^{23}}{6.02”Į1{0}^{23}}$mol=0.5mol£¬
ŌņAµÄĦ¶ūÖŹĮæĪŖ£ŗM=$\frac{14g}{0.5mol}$=28g/mol£¬ŌņAµÄĻą¶Ō·Ö×ÓÖŹĮæŹĒ28£»
ČōŅ»øö12CµÄŌ×ÓÖŹĮæŹĒb g£¬ŌņĪļÖŹµÄĮæĪŖ$\frac{b}{12}$mol£¬ĖłŅŌNA=$\frac{N}{n}$=$\frac{12}{b}$mol-1£»
¹Ź“š°øĪŖ£ŗ28£»$\frac{12}{b}$£»
£Ø2£©HCl”¢CO2”¢NH3”¢CH4ĖÄÖÖĘųĢåµÄĦ¶ūÖŹĮæ·Ö±šĪŖ36.5g/mol”¢44g/mol”¢17g/mol£¬16g/mol£¬ÉčÖŹĮ涼ĪŖ1g£¬ŌņÖŹĮæĻąµČŹ±ŗ¬ÓŠµÄŌ×ÓŹż·Ö±šĪŖ$\frac{1}{36.5}”Į2$”¢$\frac{1}{44}”Į3$”¢$\frac{1}{17}”Į4$”¢$\frac{1}{16}”Į5$£¬Ōņŗ¬ÓŠŌ×ÓŹżÄæ×ī¶ąµÄŹĒCH4£»
ÓÉV=nVm”¢¦Ń=$\frac{M}{{V}_{m}}$æÉÖŖ£¬ĻąĶ¬ĪĀ¶ČŗĶĻąĶ¬Ń¹ĒæĢõ¼ž£¬n“óµÄĢå»ż¾Ķ“ó£¬M“óµÄĆÜ¶Č¾Ķ“ó£¬ŌņĢå»ż×īŠ”µÄŹĒCO2£¬ĆܶČÓɓ󵽊”µÄĖ³ŠņŹĒ£ŗCO2£¾HCl£¾NH3£¾CH4£¬
¹Ź“š°øĪŖ£ŗCH4£»CO2£»CO2£¾HCl£¾NH3£¾CH4£»
£Ø3£©ÅØĮņĖįµÄĪļÖŹµÄĮæÅضČĪŖ£ŗc=$\frac{1000¦Ńw}{M}$=$\frac{1000”Į1.84”Į98%}{98}$=18.4mol/L£»ÉčŠčŅŖÅØĮņĖįµÄĢå»żĪŖV£¬0.2mol/L”Į0.5L=18.4mol/L”ĮV£¬V=0.0054L=5.4mL£¬
Čō“ÓÖŠČ”³ö100mlČÜŅŗ£¬ĮņĖįµÄÅØ¶Č²»±ä£¬ĘäSO42-µÄĪļÖŹµÄĮæĪŖ0.1L”Į0.2mol/L=0.02mol£»
¹Ź“š°øĪŖ£ŗ5.4£»0.02mol£®
µćĘĄ ±¾Ģāæ¼²éĮĖĪļÖŹµÄĮæµÄ¼ņµ„¼ĘĖć£¬ÄŃ¶Č²»“ó£¬×¢ŅāÕĘĪÕĪļÖŹµÄĮæÓė°¢·üŁ¤µĀĀŽ³£Źż”¢Ä¦¶ūÖŹĮ攢ĪļÖŹµÄĮæÅØ¶ČµČÖ®¼äµÄ×Ŗ»Æ¹ŲĻµ£¬ŹŌĢāÓŠĄūÓŚÅąŃųѧɜµÄ·ÖĪö”¢Ąķ½ā”¢¼ĘĖćÄÜĮ¦¼°Įé»īÓ¦ÓĆĖłŃ§ÖŖŹ¶½ā¾öŹµ¼ŹĪŹĢāµÄÄÜĮ¦£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ū¢Ü¢Ż¢ß¢ą | B£® | ¢Ł¢Ü¢ß¢ą | C£® | ¢Ł¢Ž | D£® | ¢Ł¢Ü¢Ż¢ß¢ą |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±ź×¼×“æöĻĀ£¬3.01”Į1023øöCCl4ĖłÕ¼µÄĢå»żŌ¼ĪŖ11.2 L | |
| B£® | 80 g NH4NO3¾§ĢåÖŠŌ¼ŗ¬ÓŠNH4+ 6.02”Į1023øö | |
| C£® | 3.9 gNa2O2ĪüŹÕ×ćĮæµÄCO2Ź±×ŖŅʵĵē×ÓŹżŌ¼ŹĒ3.01”Į1022 | |
| D£® | 46 g NO2ŗĶN2O4»ģŗĻĘųĢåÖŠŗ¬ÓŠŌ×ÓŹżŌ¼ĪŖ1.806”Į1024 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
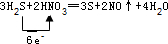 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
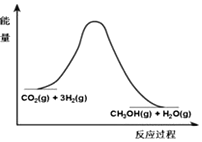 ÓÉÓŚĪĀŹŅŠ§Ó¦ŗĶ׏Ō“¶ĢȱµČĪŹĢā£¬ČēŗĪ½µµĶ“óĘųÖŠµÄCO2ŗ¬Įæ²¢¼ÓŅŌæŖ·¢ĄūÓĆ£¬ŅżÓĆĮĖø÷½ēµÄĘÕ±éÖŲŹÓ£®ÄæĒ°¹¤ŅµÉĻÓŠŅ»ÖÖ·½·ØŹĒÓĆCO2Éś²śČ¼ĮĻ¼×“¼£®Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2£Øg£©+3H2£Øg£©?CH3OH£Øg£©+H2O£Øg£©£¬øĆ·“Ó¦µÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£ŗ
ÓÉÓŚĪĀŹŅŠ§Ó¦ŗĶ׏Ō“¶ĢȱµČĪŹĢā£¬ČēŗĪ½µµĶ“óĘųÖŠµÄCO2ŗ¬Įæ²¢¼ÓŅŌæŖ·¢ĄūÓĆ£¬ŅżÓĆĮĖø÷½ēµÄĘÕ±éÖŲŹÓ£®ÄæĒ°¹¤ŅµÉĻÓŠŅ»ÖÖ·½·ØŹĒÓĆCO2Éś²śČ¼ĮĻ¼×“¼£®Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO2£Øg£©+3H2£Øg£©?CH3OH£Øg£©+H2O£Øg£©£¬øĆ·“Ó¦µÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£ŗ| t/min | 0 | 2 | 5 | 10 | 15 |
| n£ØCO2£©/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ź³ŃĪ”¢µĖ® | B£® | ĀČ”¢ä唢µā | C£® | ÄĘ”¢Ć¾ | D£® | ÉÕ¼ī”¢ĒāĘų |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com