
| A. | 11.5g/mol | B. | 24.3g/mol | C. | 48.4g/mol | D. | 16.2g/mol |
分析 由于是将一定量的O2、CO2和H2O的混合气体经过一定量的碱石灰,即碱石灰不一定充足,故应分情况讨论:
(1)碱石灰足量时,CO2和H2O被完全吸收,得到的气体为O2;
(2)碱石灰不足量时,CO2和H2O只能被部分吸收,故得到的气体可能为O2、CO2和H2O或O2,CO2或O2,H2O.
据此分析.
解答 解:由于是将一定量的O2、CO2和H2O的混合气体经过一定量的碱石灰,即碱石灰不一定充足,故应分情况讨论:
(1)碱石灰足量时,CO2和H2O被完全吸收,得到的气体为O2,此时所得气体的相对分子质量为32g/mol;
(2)碱石灰不足量时,CO2和H2O只能被部分吸收,故得到的气体可能为O2、CO2、H2O或O2,CO2或O2,H2O.
I、当得到的混合气体为O2、CO2、H2O时,气体的平均摩尔质量应大于18g/mol,小于44g/mol;
II、当得到的混合气体为O2,CO2时,气体的平均摩尔质量应大于32g/mol,小于44g/mol;
III、当得到的混合气体为O2,H2O时,气体的平均摩尔质量应大于18g/mol,小于32g/mol;
综上分析可知,混合气体的平均摩尔质量介于18g/mol到44g/mol之间,故选B.
点评 本题考查了混合气体的平均摩尔质量的求算,应注意到利用一定量碱石灰这个隐含的条件来分析出所得的气体,而固体质量增加了5.4g是个干扰条件,难度适中.


科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏 | B. | 煤的干馏 | ||
| C. | 氧气变臭氧 | D. | 乙烯通入溴水,溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 变成
变成 .现有某烯烃A,分子式为C4H8,被酸性高锰酸钾溶液氧化后不可能得到的产物是( )
.现有某烯烃A,分子式为C4H8,被酸性高锰酸钾溶液氧化后不可能得到的产物是( )| A. | CH3COOH | B. | CO2和 | ||
| C. | CO2和CH3CH2COOH | D. | HCOOH和CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 符合的条件 | 序号 | |
| 1 | 混合物 | |
| 2 | 电解质,但熔融状态下并不导电 | |
| 3 | 电解质,但难溶于水 | |
| 4 | 非电解质 | |
| 5 | 既不是电解质,也不是非电解质,但能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O的摩尔质量是18g | |
| B. | 一个12C的实际质量约等于$\frac{12}{6.02×1{0}^{23}}$g | |
| C. | 任何物质的摩尔质量都等于它的式量 | |
| D. | SO2的摩尔质量是64g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
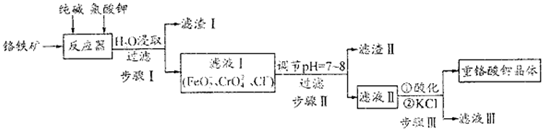
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com