
分析 一般来说,活泼金属与非金属形成离子键,非金属元素之间形成共价键,含离子键的一定为离子化合物,由分子构成的物质只有①②④,②为直线结构,④为正四面体结构,由原子构成只含共价键的为原子晶体,以此来解答.
解答 解:①Ne中不含化学键,
②CO2只含共价键,为直线型分子;
③SiO2只含共价键,由原子构成,为原子晶体;
④CH4只含共价键,为正四面体结构分子;
⑤Na2O2中含离子键、共价键,是离子化合物,且阳离子与阴离子个数之比是2:1;
⑥MgCl2中只含离子键,且阳离子与阴离子的个数比为1:2,
其中不存在化学键的是①,属于原子晶体的是③,是离子化合物,且离子个数之比是2:1或1:2的是⑤⑥,只含共价键且为直线型分子的是②,既含有离子键又有共价键的是⑤,为正四面体结构的分子是④,
故答案为:①;③;⑤⑥;②;⑤;④.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温下两种溶液①0.1mol/L CH3COOH溶液 ②0.3mol/L CH3COOH溶液与0.1mol/LNaOH溶液等体积的混合液 c(H+):①<② | |
| B. | 常温下将NaHCO3与NaHSO3混合溶于水,恰好呈中性的溶液中:c(Na+)=c(HCO3-)+c(HSO3-)+2c(CO32-)+2c(SO32-) | |
| C. | 相同条件下,pH=9的①CH3COONa溶液、②NH3•H2O溶液、③NaOH溶液中由水电离出的c(OH-):①>②>③ | |
| D. | 已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水鉴别Al3+和Mg2+ | |
| B. | 用澄清石灰水鉴别SO2和 CO2 | |
| C. | 用稀H2SO4与Zn 反应制备H2 | |
| D. | 加热蒸干氯化铜溶液得到氯化铜晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ |
| MgSO4 | 22 | 28.2 | 33.7 | 38.9 |
| NaCl | 35.7 | 35.8 | 35.9 | 36.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
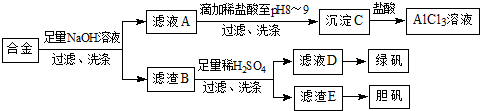
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | abdc | B. | cdba | C. | abcd | D. | dbca |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单气态氢化物的热稳定性:Y>X | |
| B. | 最高价氧化物对应水化物的酸性:X>W | |
| C. | X、Z、W的所有氧化物均能与NaOH溶液反应 | |
| D. | 化合物WY2与XY2中都只含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇是弱电解质 | B. | 所有烯烃都符合通式CnH2n | ||
| C. | 丙烯可发生加聚反应生成聚丙烯 | D. | 煤干馏可得到甲醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com