
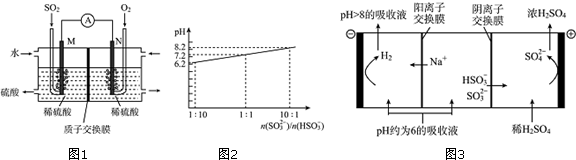
分析 (1)该装置是原电池,反应原理为二氧化硫、氧气和水反应生成硫酸,负极上的物质失电子发生氧化反应,正极上的物质得电子发生还原反应,据此分析M极发生的电极反应式;
(2)根据Q=It和N=$\frac{Q}{e}$结合SO2-2e-+2H2O=4H++SO42-计算;
(3)SO2被Na2SO3溶液吸收生成亚硫酸氢钠,硫酸氢钠是强电解质完全电离;
(4)①NaHSO3溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据图象知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性,亚硫酸氢根离子既能水解又能电离,亚硫酸氢钠溶液呈酸性同时说明HSO3-的电离程度大于水解程度,随$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$的减小,PH逐渐减小,PH减小,当$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:10,PH=6.2,溶液已显酸性,当为NaHSO3溶液,溶液PH一定小于6.2;
②$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:1,溶液为NaHSO3溶液和Na2SO3溶液,溶液PH=7.2,溶液略显碱性,说明HSO3-的电离程度小于水解程度;
(5)①阳极上阴离子放电发生氧化反应;
②阴极上为阳离子H+得电子生成氢气.
解答 解:(1)该装置是原电池,反应原理为二氧化硫、氧气和水反应生成硫酸,通入氧气的N电极是正极,原电池放电时,氢离子由负极移向正极,正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4e-+4H+=2H2O,负极M上,二氧化硫失电子和水反应生成硫酸,电极反应式为:SO2-2e-+2H2O=4H++SO42-,
故答案为:SO2-2e-+2H2O=4H++SO42-;
(2)根据Q=It=2A×60s=120C,N=$\frac{Q}{e}$=$\frac{120}{1.6×1{0}^{-19}}$=7.5×1020个,
由SO2~~~~2e-
22.4 2×6.02×1023
V 7.5×1020
V=$\frac{22.4×7.5×1{0}^{20}}{2×6.02×1{0}^{23}}$≈0.014L,
故答案为:0.014;
(3)SO2被Na2SO3溶液吸收生成亚硫酸氢钠,离子反应为SO32-+SO2+H2O=2HSO3-,故答案为:SO32-+SO2+H2O=2HSO3-;
(4)①图象分析可知,$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:1,溶液PH=7.2,$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$<1:1,PH<7,溶液显酸性,$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:10,PH=6.2,溶液显酸性,所以当为NaHSO3溶液,NaHSO3溶液中HSO3-存在电离平衡,HSO3-?H++SO32- 和水解平衡:HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度,溶液显酸性,随$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$的减小,PH逐渐减小,PH减小,当$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:10,PH=6.2,溶液已显酸性,当为NaHSO3溶液,溶液PH一定小于6.2,溶液显酸性,
故答案为:随$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$的减小,PH逐渐减小,PH减小,当$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:10,PH=6.2,溶液已显酸性,当为NaHSO3溶液,溶液PH一定小于6.2,溶液显酸性;
②$\frac{n(S{{O}_{3}}^{2-})}{n(HS{{O}_{3}}^{-})}$=1:1,溶液为NaHSO3溶液和Na2SO3溶液,溶液PH=7.2,溶液略显碱性,说明HSO3-的电离程度小于水解程度,溶液中离子浓度大小为:c(Na+)>c(SO32-)=c(HSO3-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(SO32-)=c(HSO3-)>c(OH-)>c(H+);
(5)①当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,
故答案为:HSO3-+H2O-2e-=SO42-+3H+;
②阴极上为阳离子H+得电子生成氢气,其电极反应式为:2H++2e-=H2↑,所以当电极上有2mol电子转移时,生成1mol氢气,即阴极产物的质量为2g,
故答案为:2g.
点评 本题综合性较大,涉及到离子方程式、电解原理和离子浓度大小的比较、化学平衡影响因素以及电化学知识等知识点,为高考常见题型,侧重于学生的分析能力的考查,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Al3+、F-、Ne | B. | Na+、F-、S2-、Ar | ||
| C. | K+、Ca2+、S2-、Ne | D. | Mg2+、Na+、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种饮料中不含任何化学物质 | |
| B. | 没有水就没有生命 | |
| C. | 这种口服液含丰富的氮、磷、锌等微量元素 | |
| D. | 这种蒸馏水绝对纯净,其中不含任何离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: | |
| B. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| C. | S2-的结构示意图: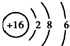 | |
| D. | O原子的基态电子排布式为:1s22s22p${\;}_{x}^{2}$p${\;}_{y}^{2}$p${\;}_{z}^{0}$. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:l | B. | 2:2:1 | C. | 2:3:l | D. | 4:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g | B. | 2.8 g | C. | 11.2g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑦ | B. | ③⑥⑦ | C. | ④⑤⑥ | D. | ①②③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Al3+、Mg2+、NO3-,可能有NH4+、K+ | |
| B. | 肯定有Al3+、K+、Cl-,肯定没有MnO4-、Mg2+ | |
| C. | 肯定有Al3+、NH4+、Cl-、NO3-,一定没有HCO3-、Mg2+、MnO4- | |
| D. | 该溶液可能显弱酸性,也可能显中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com