
.根据下列化学实验示意图及表中实验现象,从理论上分析得出的结论正确的是( )
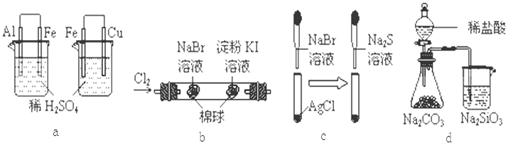
| 选项 | 实验 | 实验现象 | 结论 |
| A | a | 左烧杯铁表面有气泡,右烧杯铜表面有气泡 | 活动性:Al>Fe>Cu |
| B | b | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | c | 白色固体先变为淡黄色,后变为黑色 | 溶解度:AgCl < AgBr <Ag2S |
| D | d | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
有关碰撞理论,下列说法中正确的是( )
|
| A. | 具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应 |
|
| B. | 增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 |
|
| C. | 升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
|
| D. | 催化剂不影响反应活化能,从而只影响反应速率不影响化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
1996年诺贝尔化学奖授予斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域.后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300~500个碳原子的新物质,其分子中只含有交替连接的单键和叁键.对于C60与棒碳,下列说法正确的是( )
|
| A. | C60与棒碳中所有的化学键都是非极性共价键 |
|
| B. | 棒碳不能使溴水褪色 |
|
| C. | C60在一定条件下可能与CuO发生置换反应 |
|
| D. | 棒碳与乙炔互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
黄曲霉素是污染粮食的真菌霉素,其结构如图,人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.下列的说法正确的是( )

|
| A. | 黄曲霉素能发生取代反应和消去反应 |
|
| B. | 1mol黄曲霉素能与6mol氢气发生加成反应 |
|
| C. | 1mol黄曲霉素能与含1mol NaOH的水溶液完全反应 |
|
| D. | 黄曲霉素能与溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
菠萝酯是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸 ﹣O﹣CH2﹣COOH发生酯化反应的产物.
﹣O﹣CH2﹣COOH发生酯化反应的产物.
(1)甲一定含有的官能团的名称是 .
(2)5.8g甲完全燃烧可产生0.3molCO2和0.3molH2O,甲蒸气对氢气的相对密度是29,其分子式 ,甲分子中不含甲基,且为链状结构,其结构简式是 .
(3)已知:
R﹣CH2﹣COOH
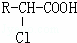 R﹣ONa
R﹣ONa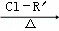 R﹣O﹣R′(R﹣,﹣R′代表烃基)
R﹣O﹣R′(R﹣,﹣R′代表烃基)
菠萝酯的合成线路如下:
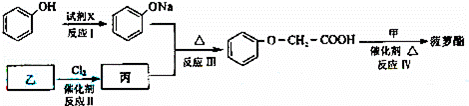
①试剂X不可选用的是(选填字母) .
a、CH3COONa溶液 b、NaOH溶液 c、NaHCO3溶液 d、Na
②丙的结构简式是 ,反应Ⅱ的反应类型是 .
③反应Ⅳ的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某工业废水中可能含有如下几种阴阳离子:
| 阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废水中的一种阴离子(X)。若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)
Al + X + OH- =AlO2-+ NH3 + N2 +
该反应的还原产物是 。若除去0.2mol X离子,要消耗铝 g。
(4)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )

A.反应的化学方程式为:2MN
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有NaBr、KI的溶液中通入过量的Cl2,然后将溶液蒸干,并灼烧固体,最后得到的物质是( )
|
| A. | KCl | B. | NaCl和KCl | C. | NaCl和KBr | D. | NaCl、KCl和I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com