

| A���Ҵ��ڷ�Ӧ�з�����������Ӧ |
| B��Ϊ��ǿ���Ч�������������ữ�ظ������Һ |
| C��ÿ1 mol�Ҵ����뷴Ӧת�Ƶ������ʵ���Ϊ4mol |
| D���Ҵ�������һ�ֽ������Դ |


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������Һ��pH=a��������Һϡ��1������Һ��pH=b����a��b | ||
| B�����ʵ���Ũ�Ⱦ�Ϊ0.01 mol?L-1��CH3COOH��CH3COONa�Ļ����Һ�У�c��CH3COOH��+c��CH3COO-��=0.01mol?L-1 | ||
| C��1.0��10-3 mol?L-1�����pH=3.0��1.0��10-8mol?L-1�����pH=8.0 | ||
D��0.1mol?L-1�Ĵ�����Һ�еμ������ռ���Һ����Һ��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| A��-417.91kJ?mol -1 |
| B��-319.68kJ?mol -1 |
| C��+546.69kJ?mol -1 |
| D��-448.46kJ?mol -1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��A��C����Ԫ�ؿ���ɻ�ѧʽΪCA3�Ļ����� |
| B��F��D�γɵĻ��������ʺܲ����ã������κ��ᷴӦ |
| C��ԭ�Ӱ뾶��С˳����E��F��C��D |
| D���ǽ�����ǿ��˳����D��C��F��B |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A����ʯ�͵�����Ӧ��  ��־��װ��Ũ����IJ۹�Ӧ�� ��־��װ��Ũ����IJ۹�Ӧ��  ��־������ר��Ѻ�� ��־������ר��Ѻ�� |
| B������ȼ�յľƾ�¯�����Ӿƾ�����Ҫ��Ϩ��ƾ�¯���Ⱦƾ�¯��ȫ��ȴ����ܼ���ƾ� |
| C������ʱ���Ż�������ˮ��𣻵������ʱ��Ӧ�����жϵ�Դ����ȡ�ʵ���ʩ��� |
| D�������г���ú��й¶�����ŵ�Ũ�ҵ���ζ��Ӧ���Ͽ���ͨ�磬�в��ɴ�绰������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
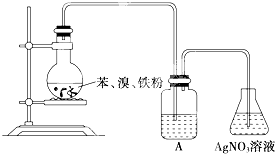
| A��ˮ |
| B��NaOH��Һ |
| C��CCl4 |
| D��NaI��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A���ṹʽ��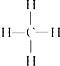 |
B�����ģ�ͣ�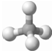 |
C������ģ�ͣ� |
D�����ӽṹʾ��ͼ��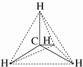 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1molFeCl3��ȫˮ������1molFe��OH��3���� |
| B�����³�ѹ�£�1NA��һ�ȼ�����ӵ��������22.4L |
| C��T��ʱ��1 L pH=6��ˮ�У���10-8NA��OH- |
| D��3.4g NH3�к�N-H����ĿΪ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������1 mol KAl��SO4��2����Һ�м���Ba��OH��2��Һ�������������ʱ���������ܵ����ʵ���Ϊ2.5 mol |
| B��FeCl2��Fe��OH��3����ͨ�����Ϸ�Ӧ�Ƶ� |
| C����ˮ�����c��H+��Ϊ10-13mol/L����Һ��Na+��NO3-��SO42-��I-һ���ܴ������� |
| D��������Ũ�����ữ��KMnO4��Һ��H2O2��ϣ���֤��H2O2���л�ԭ�ԣ�2MnO4-+8H++5H2O2=2Mn2++5O2��+8H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com