
| A. | 是易导电的银白色金属 | B. | Tl(OH)3是两性氢氧化物 | ||
| C. | Tl3+能形成+3价的化合物 | D. | 单质能与稀硝酸反应生成硝酸盐 |
分析 铊和铝都位于周期表第ⅢA族,原子核外有3个电子,最高化合价为+3价,能形成+3价的离子化合物,同主族元素从上到下元素的金属性逐渐增强,对应金属单质的熔点逐渐降低,硬度减小.
解答 解:A、同主族元素从上到下元素的金属性逐渐增强,具有强氧化性,所以为易导电的银白色金属,故正确;
B、同主族元素从上到下元素的金属性逐渐增强,则铊的金属性强于铝,所以Tl(OH)3不是两性氢氧化物,故B错误;
C、同主族元素化合价相似,性质相似,根据铝离子的性质,可以知道:Tl3+能形成+3价的化合物,故C正确;
D、硝酸具有强氧化性,与金属反应生成NO或NO2、硝酸盐,故D正确.
故选B.
点评 本题考查同主族元素的性质的递变规律,题目难度不大,本题注意把握相关性质的递变规律.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 实验目的 |
| A | 钠和镁分别投入冷水中 | 判断钠和镁的金属性强弱 |
| B | 在MgCl2和AlCl3溶液中分别加入过量的氨水 | 判断镁和铝的金属性强弱 |
| C | 向硅酸钠溶液中通入CO2 | 判断碳酸与硅酸的酸性强弱 |
| D | 将少量溴水加入盛有碘化钾溶液的试管中,用力振荡后加入少量四氯化碳,静置 | 判断溴与碘的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
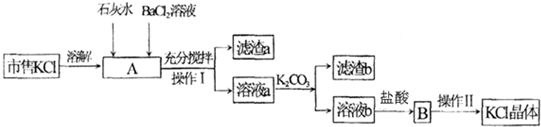
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
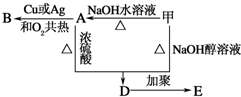
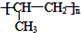 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直接排放工业废气 | B. | 改进汽车尾气净化技术 | ||
| C. | 采用焚烧方法处理垃圾 | D. | 过度开采和使用化石燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用向上排空气法收集氢气 | |
| B. | 往燃着的酒精灯中添加酒精 | |
| C. | 用丁达尔现象鉴别胶体和溶液 | |
| D. | 稀释浓硫酸时,将水沿器壁慢慢注入酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 最高正化合价 (或最低负化合价) | -4 | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将纯水加热至较高温度,Kw变大、pH变小、呈酸性 | |
| B. | 保存FeSO4溶液时,应在其中加入稀HNO3以抑制Fe2+水解 | |
| C. | 向0.1 mol•L-1 氨水中加入少量水,pH减小,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| D. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com