
| A. | 升高温度、降低压强、增加氮气 | B. | 降低温度、增大压强、加入催化剂 | ||
| C. | 升高温度、增大压强、增加氮气 | D. | 降低温度、增大压强、分离出部分氨 |
分析 为了使H2的转化率增大,一般使可逆反应3H2(g)+N2(g)?2NH3(g)△H<0向正反应方向移动,但增大氢气的浓度,平衡向正反应方向移动,但H2的转化率减小,据此分析.
解答 解:为了使H2的转化率增大,一般使可逆反应3H2(g)+N2(g)?2NH3(g)△H<0向正反应方向移动,又该反应为气体体积减小的放热反应,所以可以降低温度,增大压强都能向正反应方向移动,H2的转化率增大,催化剂不改变平衡移动,分离出部分氨也能使平衡向正反应方向移动,H2的转化率增大,故选:D.
点评 本题考查化学平衡的移动等知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握相关知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
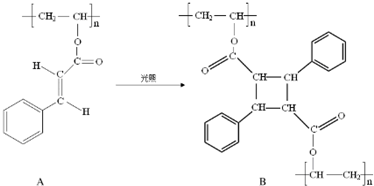
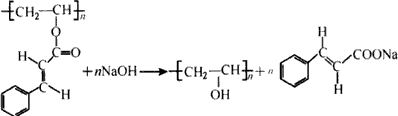 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能发生丁达尔效应的分散系有氯化钠溶液、水等 | |
| B. | 在1 L 2 mol•L-1 Fe(OH)3胶体中,含有的Fe(OH)3胶体粒子数为2NA | |
| C. | 在Fe(OH)3胶体中滴入少量稀硫酸将有沉淀产生 | |
| D. | 淀粉胶体中含有少量的NaCl,可用适量AgNO3溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
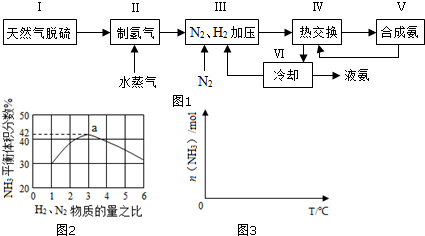
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8 | B. | 1.3 | C. | 3.1 | D. | 0.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100 mL 1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 在100 mL 2 mol•L-1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取18.0g固体,在空气中充分灼烧,质量增加1.6g;另取18.0g固体溶于足量稀盐酸,充分反应后,得到标况下气体3.36L(气体全部逸出),说明固体中一定含NaCl | |
| B. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| C. | 取一定量固体,溶解,向溶液中滴加足量盐酸溶液,观察到有气体产生,将产生的气体通入澄清石灰水中变浑浊,说明原固体中一定含有Na2CO3 | |
| D. | 取一定量固体,溶解,向溶液中滴加适量Ca(NO3)2 溶液,观察到产生白色沉淀,说明原固体中一定含有Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
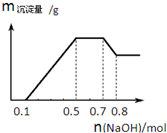 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉 淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉 淀的物质的量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中的阳离子只有H+、NH4+、Mg2+、Al3+ | |
| B. | 溶液中n(NH4+)=0.1mol | |
| C. | 溶液中一定不含CO32-,可能含有SO42-和NO3- | |
| D. | 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com