
| 500℃ |
| 1000℃ |
| 1000℃ |
| x | y | z |
| 500℃ |
| 1000℃ |
| 1000℃ |
| 0.16g |
| 32g/mol |
| 2.162L |
| 22.4L/mol |
| 0.0817mol×106g/mol |
| 10g |
| 500℃ |
| 1000℃ |
| 1000℃ |
| amol |
| x |
| a |
| 2x |
| a |
| 2x |
| 53a |
| x |
| 4a |
| x |
| a |
| 2 |
| a |
| 2 |
| x | y | z |
| x>1 | 53a/x | 4a/x |
| x≤1 | 53a | 4a |


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:上海市黄浦区2013年高考一模化学试题 题型:038
纯碱是主要的化工原料,化学家发明了其不同的工业制法,其中法国化学家尼古拉斯·勒布朗早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法.该方法包括以下两个阶段:首先从原料氯化钠与浓硫酸在高温下的反应得到中间产物硫酸钠,然后通过硫酸钠与木炭和碳酸钙的反应来得到碳酸钠.各步骤反应的化学方程式如下:
①2NaCl+H2SO4![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
②Na2SO4+2C![]() Na2S+2CO2↑
Na2S+2CO2↑
③Na2S+CaCO3![]() Na2CO3+CaS
Na2CO3+CaS
完成下列计算(计算过程保留3位有效数字)
1.假设每一步反应物的量足够,反应完全,理论上每获得1 kg纯度为80%的纯碱需要氯化钠的的质量是________kg.
2.步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是________.若其它条件不变,步骤②按此反应进行,每获得1 kg纯度为80%的纯碱需要氯化钠的的质量是________kg,此时消耗碳单质的量
是原步骤②反应用碳量的________倍.
3.通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10 g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16 g,另取10 g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162 L,计算求出该产品中Na2CO3的纯度.
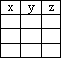
4.若除氯化钠和碳单质的量外,其它反应物足量,反应充分,如果加入a mol氯化钠时,生成的Na2CO3为yg,电子转移数为z mol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市黄浦区高三上学期期末教学质量调研化学试卷(解析版) 题型:计算题
纯碱是主要的化工原料,化学家发明了其不同的工业制法,其中法国化学家尼古拉斯·勒布朗早在1791年发明的工业合成碳酸钠的方法,简称勒布朗制碱法。该方法包括以下两个阶段:首先从原料氯化钠与浓硫酸在高温下的反应得到中间产物硫酸钠,然后通过硫酸钠与木炭和碳酸钙的反应来得到碳酸钠。各步骤反应的化学方程式如下:
2NaCl+H2SO4 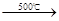 Na2SO4+2HCl↑
Na2SO4+2HCl↑
Na2SO4+2C
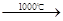 Na2S+2CO2↑
Na2S+2CO2↑
Na2S+CaCO3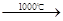 Na2CO3+CaS
Na2CO3+CaS
完成下列计算(计算过程保留3位有效数字)
(1)假设每一步反应物的量足够,反应完全,理论上每获得1kg纯度为80%的纯碱需要氯化钠的的质量是_________kg。
(2)步骤②碳单质过量时也同样可以反应获得Na2S,此时所发生的反应的化学方程式是___________________________________。若其它条件不变,步骤②按此反应进行,每获得1kg纯度为80%的纯碱需要氯化钠的的质量是__________kg,此时消耗碳单质的量是原步骤②反应用碳量的____倍。
(3)通过定性分析,勒布朗制碱法获得的纯碱含有杂质CaCO3和CaS,为了测定产品纯度,取10g样品与稀硝酸反应,硫元素全部转化成淡黄色固体,称量其质量为0.16g,另取10g样品与稀盐酸反应,得到气体(忽略气体在水中的溶解),折算为标况下,体积为2.162L,计算求出该产品中Na2CO3的纯度。
(4)若除氯化钠和碳单质的量外,其它反应物足量,反应充分, 如果加入amol氯化钠时,生成的Na2CO3为yg,电子转移数为zmol,讨论分析当氯化钠与碳的物质的量之比x的值不同时,用函数式表示y和z的值是多少。
|
x |
y |
z |
|
|
|
|
|
|
|
|
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济宁市高三第二次模拟考试理综化学试卷(解析版) 题型:计算题
纯碱和硫酸都是重要的化工原料,用途非常广泛。
(1)利用氨碱法得到的碳酸氢钠经煅烧生成纯碱。工艺流程如下图所示:
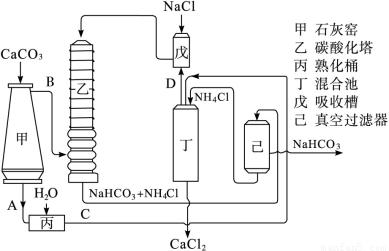
氨碱法示意图
图中的中间产物C是_________,D是________(写化学式);装置乙中发生反应的化学方程式为_________________________________。
(2)火山喷发所产生的硫磺可用于生产重要的化工原料硫酸。甲企业用接触法生产硫酸采用的主要原料是硫磺和空气。工艺流程如下图所示:
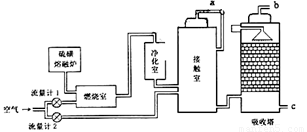
为了充分利用反应放出的热量,接触室中应安装____________(填设备名称)。吸收塔中填充许多瓷管,其作用是____________。为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2的转化率,经流量计2的氧气量为接触室中SO2完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
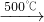 Na2SO4+2HCl↑
Na2SO4+2HCl↑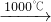 Na2S+2CO2↑
Na2S+2CO2↑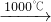 Na2CO3+CaS
Na2CO3+CaS| x | y | z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com