
分析 甲厂废水呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl--、OH-不能共存,根据溶液电中性可知乙厂还有NO3-,
由此可知:甲厂含有K+、Cl--、OH-,乙厂含有Ag+、Fe3+、NO3-,根据两厂中含有的离子组成及性质解答该题.
解答 解:(1)甲厂废水呈碱性,则溶液中含有大量的OH-,与OH-离子反应的Ag+、Fe3+不能大量共存,根据溶液电中性可知甲厂废水中应含有K+,乙厂中含有Ag+、Fe3+,则与Ag+、Fe3+反应的Cl--、OH-不能共存,根据溶液电中性可知乙厂还有NO3-,
由此可知:甲厂含有K+、Cl--、OH-,乙厂含有Ag+、Fe3+、NO3-,
故答案为:K+、Cl-、OH-;
(2)含有的金属离子有K+、Ag+、Fe3+,加入单质Fe,可置换出Ag,
故答案为:铁粉;Ag;
(3)将甲厂和乙厂的废水按适当的比例混合,可生成AgCl、Fe(OH)3沉淀,生成沉淀的离子有Ag+、Fe3+、Cl-、OH-等,经过滤后的废水主要KNO3,名称为硝酸钾,
故答案为:Ag+、Fe3+、Cl-、OH-;硝酸钾.
点评 本题考查较为综合,涉及离子共存以及离子检验等问题,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意判断甲乙厂废水成分的角度以及离子的性质.


科目:高中化学 来源: 题型:选择题
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至10倍后pH=4 | |
| C. | 0.2 mol•L-1的盐酸与等体积水混合后pH=1 | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 60% | C. | 40% | D. | 80% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 加入氢氧化钠溶液,通过分液的方法,可以除去苯中的乙酸 | |
| C. | 将氢气和氧气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| D. | 用萃取的方法分离汽油和煤油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
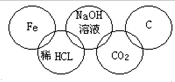 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )| A. | 1个、复分解反应 | B. | 2个、分解反应 | C. | 3个、化合反应 | D. | 2个、置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题:
黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com