
| ČõĖį | CH3COOH | HCN | H2CO3 |
| µēĄėĘ½ŗā³£Źż | 1.8”Į10-5 | 4.9”Į10-10 | K1=4.3”Į10-7 K2=5.6”Į10-11 |
| A£® | µČĪļÖŹµÄĮæÅضČČÜŅŗµÄpH¹ŲĻµĪŖpH£ØNaCN£©£¾pH£ØNa2CO3£©£¾pH£ØCH3COONa£© | |
| B£® | a mol•L-1HCNČÜŅŗÓėb mol•L-1NaOHČÜŅŗµČĢå»ż»ģŗĻŗó£¬ĖłµĆČÜŅŗÖŠ£ŗc£ØNa+£©£¾c£ØCN-£©£¬ŌņaŅ»¶ØŠ”ÓŚb | |
| C£® | Ķł±ł“×ĖįÖŠÖšµĪ¼ÓĖ®£¬ČÜŅŗµÄµ¼µēŠŌÖš½„Ōö“ó | |
| D£® | ½«0.2 mol•L-1 KHCO3ČÜŅŗÓė0.1 mol•L-1 KOHČÜŅŗµČĢå»ż»ģŗĻ£ŗc£ØK+£©+c£ØH+£©=c£ØOH-£©+c£ØHCO${\;}_{3}^{-}$£©+2c£ØCO${\;}_{3}^{2-}$£© |
·ÖĪö A£®ĖįµÄµēĄėĘ½ŗā³£ŹżŌ½“ó£¬ĖįøłĄė×ÓĖ®½ā³Ģ¶ČŌ½Š”£¬ĻąĶ¬ÅØ¶ČµÄÄĘŃĪČÜŅŗpHŌ½Š”£»
B£®HCNÓėNaOHĒ”ŗĆ·“Ӧɜ³ÉNaCN£¬CN-·¢ÉśĖ®½āÅØ¶Č¼õŠ”£»
C£®ČÜŅŗµ¼µēÄÜĮ¦ÓėĄė×ÓÅØ¶Č³ÉÕż±Č£»
D£®0.2 mol•L-1 KHCO3ČÜŅŗÓė0.1 mol•L-1 KOHČÜŅŗµČĢå»ż»ģŗĻÉś³ÉK2CO3£¬KHCO3ÓŠŹ£Óą£¬øł¾ŻµēŗÉŹŲŗć·ÖĪö£®
½ā“š ½ā£ŗA£®ĖįµÄµēĄėĘ½ŗā³£ŹżŌ½“ó£¬ĖįøłĄė×ÓĖ®½ā³Ģ¶ČŌ½Š”£¬ĻąĶ¬ÅØ¶ČµÄÄĘŃĪČÜŅŗpHŌ½Š”£¬Ė®½ā³Ģ¶ČCO32-£¾CN-£¾CH3COO-£¬ŌņÕāČżÖÖŃĪpH“óŠ”Ė³ŠņŹĒpH£ØNa2CO3£©£¾pH£ØNaCN£©£¾pH£ØCH3COONa£©£¬¹ŹA“ķĪó£»
B£®HCNÓėNaOHĒ”ŗĆ·“Ӧɜ³ÉNaCN£¬CN-·¢ÉśĖ®½āÅØ¶Č¼õŠ”£¬ĖłŅŌNaCNČÜŅŗÖŠc£ØNa+£©£¾c£ØCN-£©£¬“ĖŹ±a=b£¬¹ŹB“ķĪó£»
C£®ČÜŅŗµ¼µēÄÜĮ¦ÓėĄė×ÓÅØ¶Č³ÉÕż±Č£¬Ļ”ŹĶ¹ż³ĢÖŠ“Ł½ų“×ĖįµēĄė£¬ČÜŅŗÖŠĄė×ÓÅØ¶Č ĻČŌö“óŗó¼õŠ”£¬ĖłŅŌČÜŅŗµ¼µēÄÜĮ¦ĻČŌö“óŗó¼õŠ”£¬¹ŹC“ķĪó£»
D£®0.2 mol•L-1 KHCO3ČÜŅŗÓė0.1 mol•L-1 KOHČÜŅŗµČĢå»ż»ģŗĻÉś³ÉK2CO3£¬KHCO3ÓŠŹ£Óą£¬ČÜŅŗÖŠµÄµēŗÉŹŲŗćĪŖ£ŗc£ØK+£©+c£ØH+£©=c£ØOH-£©+c£ØHCO3-£©+2c£ØCO32-£©£¬¹ŹDÕżČ·£»
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²éĮĖČõµē½āÖŹµÄµēĄė¼°ŃĪĄąĖ®½ā£¬Ć÷Č·ĖįµÄĒæČõÓėĖįøłĄė×ÓĖ®½ā³Ģ¶Č¹ŲĻµŹĒ½ā±¾Ģā¹Ų¼ü£¬×¢Ņā£ŗČÜŅŗµ¼µēÄÜĮ¦ÓėĄė×ÓÅØ¶Č³ÉÕż±Č£¬Óėµē½āÖŹĒæČõĪŽ¹Ų£¬ŅדķŃ”ĻīŹĒC£®


 ĄčĆ÷ĪÄ»Æŗ®¼Ł×÷ŅµĻµĮŠ“š°ø
ĄčĆ÷ĪÄ»Æŗ®¼Ł×÷ŅµĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
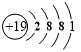 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | H2ŌŚCl2ÖŠ¾ēĮŅČ¼ÉÕ£¬·¢³ö»ĘÉ«»šŃę£¬Ć°°×ŃĢ | |
| B£® | SiO2µÄ»ÆѧŠŌÖŹ²»»īĘĆ£¬²»ÓėČĪŗĪĖį·¢Éś·“Ó¦ | |
| C£® | ³£ĪĀĻĀ£¬ĀĮ”¢ĢśÓöÅØĮņĖį»į·¢Éś¶Ū»Æ·“Ó¦ | |
| D£® | ½«ĀČĘųĶØČė×ĻÉ«ŹÆČļŹŌŅŗÖŠŅ»Š©Ź±¼äŗó£¬ČÜŅŗ±äŗģ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 A”«IĪŖ֊ѧ»Æѧ֊³£¼ūµÄĪļÖŹ£¬B”¢E”¢FĪŖµ„ÖŹ£¬ĒŅŌŚ³£ĪĀĻĀBŹĒŅ»ÖÖ»ĘĀĢÉ«ÓŠ¶¾ĘųĢ壬EĪŖ×ĻŗģÉ«½šŹō£¬GĪŖŗŚÉ«¹ĢĢ壮ĖüĆĒµÄĻą»„×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø²æ·ÖÉś³ÉĪļĪ“ĮŠ³ö£©£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
A”«IĪŖ֊ѧ»Æѧ֊³£¼ūµÄĪļÖŹ£¬B”¢E”¢FĪŖµ„ÖŹ£¬ĒŅŌŚ³£ĪĀĻĀBŹĒŅ»ÖÖ»ĘĀĢÉ«ÓŠ¶¾ĘųĢ壬EĪŖ×ĻŗģÉ«½šŹō£¬GĪŖŗŚÉ«¹ĢĢ壮ĖüĆĒµÄĻą»„×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø²æ·ÖÉś³ÉĪļĪ“ĮŠ³ö£©£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ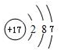 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
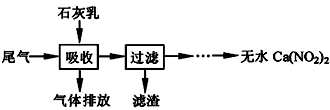
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
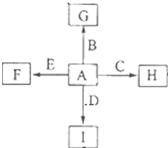 ČēĶ¼ÖŠ£¬A”¢B”¢C”¢D”¢EŹĒµ„ÖŹ£¬G”¢H”¢I”¢FŹĒB”¢C”¢D”¢E·Ö±šŗĶAŠĪ³ÉµÄ¶žŌŖ»ÆŗĻĪļ£¬ŅŃÖŖ£ŗ
ČēĶ¼ÖŠ£¬A”¢B”¢C”¢D”¢EŹĒµ„ÖŹ£¬G”¢H”¢I”¢FŹĒB”¢C”¢D”¢E·Ö±šŗĶAŠĪ³ÉµÄ¶žŌŖ»ÆŗĻĪļ£¬ŅŃÖŖ£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
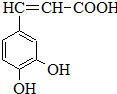 槷ČĖį£ØČēĶ¼£©£¬“ęŌŚÓŚŠķ¶ąÖŠŅ©ÖŠ£¬ČēŅ°ŗśĀܲ·”¢¹āŅ¶Ė®ĖÕ”¢ÜńĀó”¢Ä¾°ėĻÄµČ£®æ§·ČĖįÓŠÖ¹ŃŖ×÷ÓĆ£¬ĢŲ±š¶ŌÄŚŌąµÄÖ¹ŃŖŠ§¹ū½ĻŗĆ£®
槷ČĖį£ØČēĶ¼£©£¬“ęŌŚÓŚŠķ¶ąÖŠŅ©ÖŠ£¬ČēŅ°ŗśĀܲ·”¢¹āŅ¶Ė®ĖÕ”¢ÜńĀó”¢Ä¾°ėĻÄµČ£®æ§·ČĖįÓŠÖ¹ŃŖ×÷ÓĆ£¬ĢŲ±š¶ŌÄŚŌąµÄÖ¹ŃŖŠ§¹ū½ĻŗĆ£®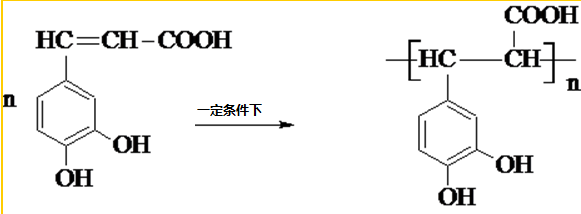 £®
£®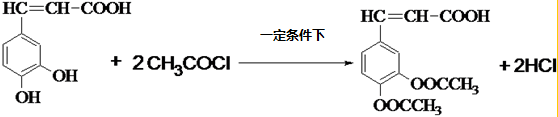 £®
£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com