
A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素。A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6。
请回答下列问题:
(1)B、C、D、E、F五种元素原子半径由大到小的顺序是________。
(2)A和C按原子个数比1:l形成4原子分子Y.Y的结构式是________。
(3)分子X的电子式是_____________;D可以在液态X中发生类似于与A2C的反应,
写出反应的化学方程式_________________________________ 。
(4)实验证明,熔融的EF3不导电,其原因是__________________________。
(5)E的单质可溶于A、C、D形成的化合物Z的水溶液中。拉曼光谱证实此反应生成的阴离子主要以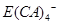 的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
(6)工业品Z的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。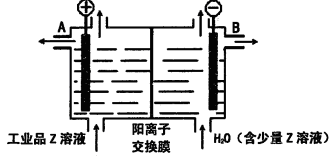
①该电解槽的阳极反应式是____________________。
②通电开始后,阴极附近溶液pH_________________(“增大”、“减小”或”不变”)。
③除去杂质后的Z溶液从液体出口___________________(填写“A”或“B”)导出。
科目:高中化学 来源: 题型:填空题
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: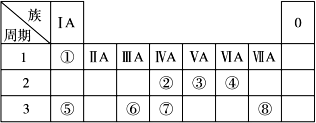
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是( )
| A.最高正化合价为+6价, | B.气态氢化物比H2S稳定, |
| C.最高价氧化物的水化物的酸性比硫酸弱, | D.单质在常温下可与氢气化合。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(l)Y在元素周期表中的位置是__________;X氢化物的电子式是__________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈__________(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是__________。
(3)Y-AgO电池是应用广泛的鱼雷电池,其原理如下图所示。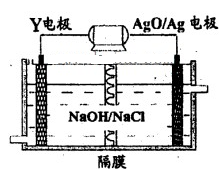
该电池的负极反应式是__________。
(4)Z和W比较,非金属性较弱的是__________(填元素符号),下列可以验证这一结论的是__________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1molH-Z或H-W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常见元素X、Y、Z、W的原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子数相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的2.5倍 |
| Z | Z的基态价电子结构为nsn-1 |
| W | W单质常在火山口附近被发现,其氧化物是造成酸雨的主要原因之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种短周期元素,原子序数依次增大,A原子的最外层电子排布式为nsnnpn+1,C、D原子核外都有一个未成对电子,又知B和E为同一主族,C、D、E为同周期,且B、E的原子序数之和等于C、D的原子序数之和
(1) E离子的基态电子排布式 _______________
(2)元素B、C、D、E的原子半径从大到小的顺序是________(用元素符号填写,下同)
(3)元素A、B、C、D的第一电离能从大到小的顺序是
(4)写出C单质与B单质加热时生成的化合物的电子式
(5) D元素在周期表中的位置是_______________,中学化学实验室中制取D的最高价氧化物对应的水化物的离子方程式为___________________________________
(6)已知:①A2(g)+B2(g)=2AB(g) ΔH1=akJ/mol
②2AB(g)+B2(g)=2AB2(g) ΔH2=bkJ/mol
③AB(g)+AB2(g)= A2B3(g) ΔH3=ckJ/mol
则2A2(g)+3B2(g)=2A2B3(g) ΔH= kJ/mol (用a.b.c表示)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D是元素周期表前四周期常见的四种元素,原子序数依次增大, 它们的相关结构和性质信息如下表所示,请结合相关信息,完成相关的问题:
| 元素 | 相关结构和性质 |
| A | A为非金属元素,其一种单质是电的良导体,难熔、质软并有润滑性,可用作电极材料 |
| B | 是蛋白质的组成元素之一,原子核外有三种不同能量的电子,且未成对电子数最多 |
| C | 其单质既能与强酸溶液应又能与强碱溶液反应,其简单离子在第三周期单核离子中半径最小 |
| D | D的高价氯化物的盐溶液常用于印刷电路极电路的“刻蚀” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,基态镍原子M层上的未成对电子数为 。
(2)大阪大学近日宣布,有机太阳能固体电池效率突破5.3%,而高纯度C60是其“秘密武器”。C60的结构如图1,分子中碳原子轨道的杂化类型为 ;1 mol C60分子中π键的数目为 。
(3)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如下图2。该结构中,碳氮之间的共价键类型有 (按原子轨道重叠方式填写共价键的类型),请在下图2中用箭头表示出配位键。

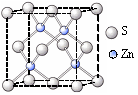
图1 图2 图3
(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等。
①第一电离能:As Se(填“>”、“<”或“=”)。
②硫化锌的晶胞中(结构如图所示),硫离子的配位数是 。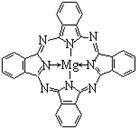
③二氧化硒分子的空间构型为 。
④砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【物质结构与性质】
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是 ,属 区元素,它的最外层电子的电子排布图为 。
(2)XZ2分子的立体结构是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
(3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是 。
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。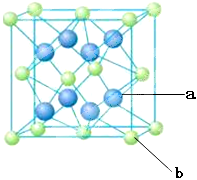
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com