
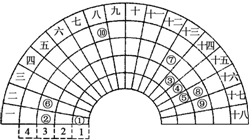
 元素周期表的形式多种多样,下图是扇形元素周期表前四周期的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表前四周期的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ②、⑧、⑨对应原子半径依次增大 | |
| B. | ②、⑨的氢化物晶体类型相同 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①、③、④、⑤形成的某种化合物中既含有共价键又含有离子键 |
分析 由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
B.氢化钠是离子晶体,而氯化氢是分子晶体;
C.元素⑩处于常见周期表第四周期第VⅢ族;
D.H与C、N、O可以形成离子化合物NH4NO3.
解答 解:由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->Na+,故A错误;
B.氢化钠是离子晶体,而氯化氢是分子晶体,所以两者晶体类型不同,故B错误;
C.元素⑩处于常见周期表第四周期第VⅢ族,故C错误;
D.H与C、N、O可以形成NH4HCO3,分子中都含有极性键、离子键,故D正确.
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握扇形元素周期表与常见元素周期表的关系为解答的关键,注意B选项中氯化铝是共价化合物,属于分子晶体.,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 无色溶液使红色石蕊试纸变蓝,结论:溶液显碱性 | |
| B. | 无色溶液焰色反应呈黄色,结论:试液是钠盐溶液 | |
| C. | 无色溶液加入Na2CO3溶液产生白色沉淀,结论:溶液中含Ca(OH)2 | |
| D. | 向溶液中加入BaCl2溶液,生成白色沉淀,再加稀HCl,沉淀不溶解,可断定含有SO42ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| B. | 碳酸钡与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 氯气与溴化钠溶液反应:Cl2+2Br-═Br2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2═2SO3△H=-196.6 kJ/mol | B. | 2H2O (g)═2H2(g)+O2(g)△H=-483.6kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | D. | C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
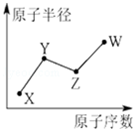 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示:
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示: ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) | B. | c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | ||
| C. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | N为乙酸 | |
| B. | 过程①中可加入LiAlH4等还原剂将乙醇转化为N | |
| C. | 过程②如果加热一段时间后发现忘记加瓷片,应停止反应,待冷却后补加 | |
| D. | 可用饱和碳酸钠溶液除去乙酸乙酯中混有的N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,增加反应物的量,必定加快反应速率 | |
| B. | 升高温度正反应速率增大,则逆反应速率也一定增大 | |
| C. | 可逆反应的特征是正反应速率总是和逆反应速率相等 | |
| D. | 使用催化剂一定会加快反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com