
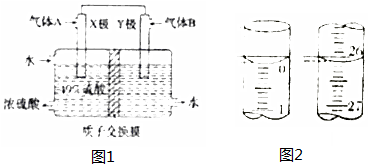
分析 (1)根据盖斯定律解题;
(2)①据X极为负极失电子发生氧化反应;
②据正极的电极反应方程式O2+4H++4e-=2H2O中的氧气求氢离子的个数;
(3)加入氢氧化钠,消耗溶液中的氢离子,促进电离平衡右移,抑制水解平衡,据此分析;
(4)①据高锰酸钾溶液为酸性分析;根据滴定管的结构和精确度以及测量的原理;
②达到滴定终点的依据是,滴加最后一滴高锰酸钾标准液,溶液恰好由无色变为浅红色且30s不褪色;
③根据高锰酸钾和亚硫酸氢钠之间的关系式计算亚硫酸氢钠的物质的量浓度.
解答 解:(1)Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
将③-②-①可得MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol,
故答案为:MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol;
(2)①X极为负极失电子发生氧化反应,故电极反应方程式为SO2-2e-+2H2O=SO42-+4H+,
故答案为:SO2-2e-+2H2O=SO42-+4H+;
②正极的电极反应方程式O2+4H++4e-=2H2O
22.4L 4NA
11.2L 2NA
则N(H+)=2NA,
故答案为:2NA;
(3)加入氢氧化钠,消耗溶液中的氢离子,促进电离平衡右移,则c(SO32-)增大,所以$\frac{c(S{{O}_{3}}^{2-})}{c(HS{{O}^{-}}_{3})}$的值增大,加NaOH,溶液中钠离子浓度增大,由于钠离子浓度增大的程度大于c(SO32-)增大程度,所以溶液中 $\frac{C(N{a}^{+})}{C(S{{O}_{3}}^{2-})}$的值增大;
故答案为:增大;增大;
(4)高锰酸钾溶液为酸性,故用酸式滴定管;滴定管小刻度在上,大刻度在下,精确值为0.01mL,起始读数为0.00mL,终点读数为26.10mL,盐酸溶液的体积为26.10mL.
故答案为:酸;26.10;
②达到滴定终点的依据是,滴加最后一滴高锰酸钾标准液,溶液恰好由无色变为浅红色且30s不褪色;
故答案为:滴加最后一滴高锰酸钾标准液,溶液恰好由无色变为浅红色且30s不褪色;
③设亚硫酸氢钠的物质的量浓度为xmol/L.
2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O.
2mol 5mol
0.0261L×0.5mol•L-1 0.02xmol 解得:x=1.631mol/L,故NaHSO3的浓度为1.631mol/L,
故答案为:1.631mol/L.
点评 本题考查了热化学方程式的书写,电极方程式书写,滴定终点判断,本题难度中等.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色植物的光合作用是把热能转化为化学能的过程 | |
| B. | 生物能是与化学反应无关的一种能源 | |
| C. | 化学能只能以热能的形式释放 | |
| D. | 葡萄糖在人体内的氧化是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
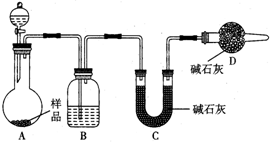 为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④ | C. | ③④ | D. | ①②⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com