
 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$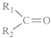 +
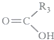
+
 .
.
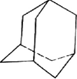 )是月桂烯的一种同分异构体,其一氯代物有2种.
)是月桂烯的一种同分异构体,其一氯代物有2种. .
. 分析 (1)①根据月桂烯含有三个双键,都能发生加成反应,且存在与1-3-丁二烯类似结构,则能发生1,4加成;
②由反应信息可知,双键被高锰酸钾酸性溶液氧化而断裂,若不饱和C原子含有H原子,则被氧化生成羧酸,即断键处的碳原子都被氧化成为羧基,若若不饱和C原子没有H原子,则断键处的碳原子都被氧化成为酮羰基,生成酮;
③根据分子中氢原子的种类等于一氯取代物的种类;
(2)根据等效氢来解答;根据Y的结构与丙酮利用信息得出烃X,然后命名;
(3)化学式为C8H12的烃Z,不饱和度为3,由反应信息可知,双键被高锰酸钾酸性溶液氧化而断裂,若不饱和C原子含有H原子,则被氧化生成羧酸,即断键处的碳原子都被氧化成为羧基,若若不饱和C原子没有H原子,则断键处的碳原子都被氧化成为酮羰基,生成酮来解答;
解答 解:(1)①分子存在三种不同的碳碳双键,如图所示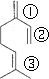 ,1分子物质与1分子Br2加成时,可以在①②③的位置上发生加成,也1分子Br2在①②发生1,4加成反应,故所得产物共有4种;
,1分子物质与1分子Br2加成时,可以在①②③的位置上发生加成,也1分子Br2在①②发生1,4加成反应,故所得产物共有4种;
故答案为:4;
②双键被高锰酸钾酸性溶液氧化而断裂,若不饱和C原子含有H原子,则被氧化生成羧酸,即断键处的碳原子都被氧化成为羧基,若若不饱和C原子没有H原子,则断键处的碳原子都被氧化成为酮羰基,生成酮,所以月桂烯与酸性高锰酸钾溶液反应时碳原子数最多的一种产物的结构简式为 ;
;
故答案为: ;
;
③分子中含2种位置的H,则一氯代物有2种;
故答案为:2;
(2)羧酸Y(C5H10O2)中仅含两种不同化学环境的氢原子,则结构简式为(CH3)3CCOOH;烃X在酸性高锰酸钾溶液中生成等物质的量的丙酮(CH3COCH3)与羧酸(CH3)3CCOOH,则烃X为(CH3)2C=CH-C(CH3)3,名称为2,4,4-三甲基-2-戊烯;
故答案为:(CH3)3CCOOH;2,4,4-三甲基-2-戊烯;
(3)化学式为C8H12的烃Z,在酸性高锰酸钾溶液中生成CH3COCH2COOH,说明1分子C8H12得到2分子CH3COCH2COOH,双键被高锰酸钾酸性溶液氧化而断裂,若不饱和C原子含有H原子,则被氧化生成羧酸,即断键处的碳原子都被氧化成为羧基,若若不饱和C原子没有H原子,则断键处的碳原子都被氧化成为酮羰基,生成酮,则Z可能的结构简式: ;
;
故答案为: ;
;
点评 本题主要考查有机物的推断,难度不大,读懂反应信息是解题的关键,能较好的考查学生的阅读、分析、思维能力,是热点题型.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:解答题
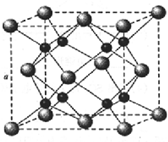 A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A原子基态时原子轨道上有两个未成对电子,A2-和B+具有相同的电子层结构;C、D为同周期元素,C元素基态原子核外电子总数是其最外层电子数的3倍;D元素基态原子的最包层有一个未成对电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长期放置的苯酚晶体变红 | B. | 硝酸银晶体光照后变黑 | ||
| C. | 氢氧化亚铁变灰绿再变红褐 | D. | 二氧化碳气体冷却后变淡 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题


| A. | 反应①、③的原子利用率均为100% | |
| B. | 两种流程最终分离HCOOH都用洗涤液分液法 | |
| C. | 从原料充分利用角度看,流程二比流程一更优 | |
| D. | 两种流程总反应均为CO+H2O→HCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=4.3 的 CH3COOH与 CH3COONa 混合溶液中 tc(Na+)<c(CH3COO-) | |
| B. | NaCl溶液和CH3COONH4,溶液均显中性,两溶液中水的电离程度相同 | |
| C. | 相同温度下,若Ksp(AgCL)>KspCAg2CrCO4),则 AgCl的溶解度大于Ag2CrCO4 | |
| D. | 向冰醣酸加少就水稀释,$\frac{c(C{H}_{3}COOH)}{{c}^{2}({H}^{+})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中共价键越强,熔点越高 | |
| B. | 分子晶体中分子间作用力越大,分子越稳定 | |
| C. | 冰熔化时水分子中共价键发生断裂 | |
| D. | CaCl2晶体中含有两种化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
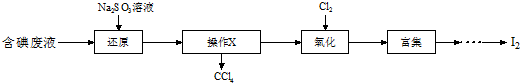

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com