
已知:Fe2O3(s)+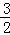 C(s)═
C(s)═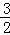 CO2(g)+2Fe(s)△H=+234.1kJ/mol
CO2(g)+2Fe(s)△H=+234.1kJ/mol
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
则:2Fe(s)+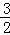 O2(g)═Fe2O3(s)的△H是()
O2(g)═Fe2O3(s)的△H是()
A. ﹣824.4 kJ/mol B. ﹣627.6 kJ/mol
C. ﹣744.7 kJ/mol D. ﹣169.4 kJ/mol
考点: 有关反应热的计算.
专题: 化学反应中的能量变化.
分析: 根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减,据此判断.
解答: 解:①Fe2O3(s)+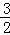 C(s)═
C(s)═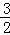 CO2(g)+2Fe(s)△H=+234.1kJ/mol
CO2(g)+2Fe(s)△H=+234.1kJ/mol
②C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
由盖斯定律②×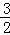 ﹣①得:2Fe(s)+
﹣①得:2Fe(s)+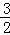 O2(g)=Fe2O3(s)△H=(﹣393.5kJ•mol﹣1)×
O2(g)=Fe2O3(s)△H=(﹣393.5kJ•mol﹣1)×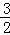 ﹣234.1kJ•mol﹣1
﹣234.1kJ•mol﹣1
即2Fe(s)+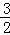 O2(g)=Fe2O3(s)△H=﹣824.4kJ•mol﹣1.
O2(g)=Fe2O3(s)△H=﹣824.4kJ•mol﹣1.
故选A.
点评: 本题考查盖斯定律的利用,难度不大,明确已知反应与目标热化学方程式的关系是关键,注意基础知识的掌握与理解.


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:简答题
(15分)用NH3催化还原NxOy可以消除氮氧化物的污染。
已知:反应I:4NH3(g)+6NO(g)  5N2(g)+6H2O(l) △H1
5N2(g)+6H2O(l) △H1
反应II:2NO(g)+O2(g)  2NO2(g) △H2 (且|△H1| =2|△H2|)
2NO2(g) △H2 (且|△H1| =2|△H2|)
反应III:4NH3(g)+6NO2(g)  5N2(g)+3O2(g)+6H2O(l) △H3
5N2(g)+3O2(g)+6H2O(l) △H3
反应I和反应II在不同温度时的平衡常数及其大小关系如下表
温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)推测反应III是 反应(填“吸热”或“放热”)
(2)相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。
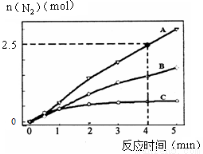
①计算0~4分钟在A催化剂作用下,反应速率v(NO)= 。
②下列说法正确的是 。
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(3)一定条件下,反应II达到平衡时体系中n(NO) ∶n(O2)∶n(NO2)=2∶1∶2。在其它条件不变时,再充入NO2气体,分析NO2体积分数——φ(NO2)的变化情况:(填“变大”、“变小”或“不变”)恒温恒压容器,φ(NO2) ;恒温恒容容器,φ(NO2) 。
(4)一定温度下,反应III在容积可变的密闭容器中达到平衡,此时容积为3 L,c(N2)与反应时间t变化曲线X如下图所示,若在t1时刻改变一个条件,曲线X变为曲线Y或曲线Z。则:

①变为曲线Y改变的条件是 。变为曲线Z改变的条件是 。
②若t2降低温度,t3达到平衡,请在上图中画出曲线X在t2- t4内 c(N2)的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
在2A(g)+B(g)⇌3C(g)+4D(g)中,表示该反应速率最快的是( )
|
| A. | υA=0.5mol•L﹣1•min﹣1 | B. | υB=0.3mol•L﹣1•min﹣1 |
|
| C. | υC=0.8mol•L﹣1•min﹣1 | D. | υD=1mol•L﹣1•min﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是一种新型的绿色能源,又是一种重要的化工原料.
合成氨反应的热化方程式如下:
N2(g)+3H2(g)⇌2NH3(g);△H=﹣92.4kJ/mol
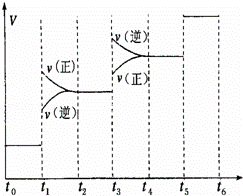
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.
图中t1时引起平衡移动的条件可能是 ,
其中表示平衡混合物中NH3的含量最高的一段时间是 ,若t0﹣t1,t1﹣t3,t3﹣t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H (填“增大”、“减小”或“不改变”).
(3)温度为T℃时,将2a mol H2和 a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关能源与能量的说法正确的是()
A. 煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源
B. 蒸汽属于一次能源
C. 凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应
D. 反应物和生成物的总能量决定反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
根据如图所示图象,写出反应的热化学方程式并回答下列问题:
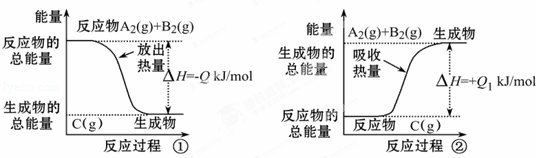
(1)反应过程①的热化学方程式为 :
(2)反应过程②的热化学方程式为:
(3)Q与Q1的关系:Q=Q1(填“<”、“>”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质性质的叙述中,正确的是( )
A.Cl2能与金属活动顺序表中大多数金属反应
B.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
C.硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性
D.硅是应用广泛的半导体材料,常温下化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
从固体混合物A出发可以发生如下框图所示的一系列变化。
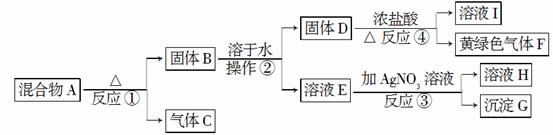
G为不溶于稀硝酸的白色固体;溶液H的焰色反应呈紫色(透过蓝色的钴玻璃观察)。回答下列问题:
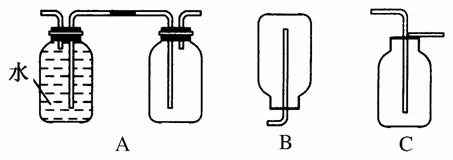
(1)在实验室中收集气体C,可选择如图装置中的________。
(2)操作②的名称是________。在操作②中所使用的玻璃仪器的名称是________。在得到固体D时必须进行洗涤、干燥等操作,洗涤固体D的目的是________________________________________。
(3)写出反应①的化学方程式、反应④的离子方程式:
反应①:_____________________________________________,
反应④:___________________________________________。
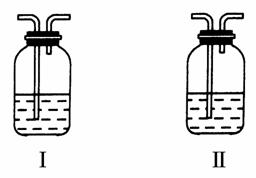
(4)在实验室中,要获得干燥纯净的黄绿色气体F,可以将它依次通过如图中的Ⅰ、Ⅱ装置,其中瓶Ⅰ中盛放的是________,瓶Ⅱ中盛放的是________。
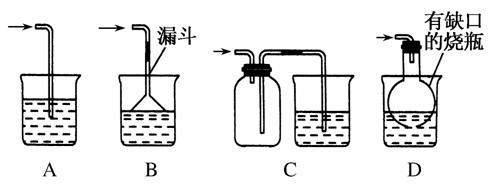
(5)实验中必须吸收多余的气体F,以免污染空气。下图是实验室用NaOH溶液吸收气体F的装置,为防止产生倒吸现象,合理的装置是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用.
(1)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体.
①写出该反应的离子方程式:.
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝.若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:;为抑制肼的分解,可采取的合理措施有(任写一种).
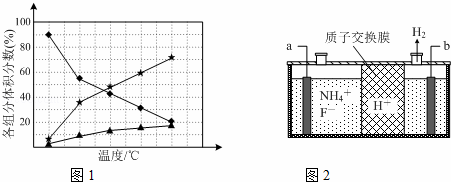
(2)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示.
①氮化硅的化学式为
②a电极为电解池的阳(填“阴”或“阳”)极,写出该电极的电极反应式:电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是F2.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com