
| A. | 原子半径:Na<Cl | B. | 热稳定性:HCI<HF | ||
| C. | 离子半径:F-<Mg2+ | D. | 碱性:NaOH<Mg(OH)2 |
分析 A、同周期从左到右原子半径逐渐减小;
B、根据离子的电子排布分析;
C、元素的非金属性越强,则氢化物的稳定性越强;
D、元素的金属性越强,对应最高价氧化物水化物的碱性越强.
解答 解:A、同周期从左到右原子半径逐渐减小,则原子半径:Na>Cl,故A错误;
B、非金属性:F>Cl,元素的非金属性越强,则氢化物的稳定性越强,所以热稳定性:HF>HCl,故B正确;
C、F-和Mg2+的核外电子排布相同,核电荷数越大的,半径越小,故F->Mg2+,故C错误;
D、元素的金属:Na>Mg,金属性越强,对应最高价氧化物水化物的碱性越强,则碱性:NaOH>Mg(OH)2,故D错误;
故选B.
点评 本题考查了元素周期律,熟悉非金属元素和金属元素的性质变化规律及非金属性的比较方法即可解答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因.
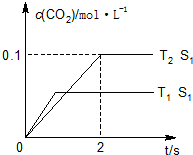
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO2(g) | H2(g) | H2O(g) | CO2(g) | |||
| 1 | 650 | 2 | 1 | 0.4 | 1.6 | 6 |
| 2 | 900 | 4 | 2 | 1.6 | 2.4 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,在水中的溶解度:乙二醇>乙醇>苯酚 | |
| B. | 用质谱法可确定有机物分子中的官能团 | |
| C. | 用核磁共振氢谱能够区分CH3CH2CHO和CH3COCH3 | |
| D. | 乙二酸、甲醛、苯乙烯均可发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打NaHCO3 | B. | 烧碱NaOH | C. | 绿矾FeSO4•7H2O | D. | 钡餐BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.6mol | C. | 0.8mol | D. | l.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解硝酸银溶液不可能在电极上生成银,因为银可以溶于硝酸 | |
| B. | 25℃,惰性电极电解氢氧化钠溶液,溶液PH不变,因为实质是电解水 | |
| C. | 惰性电极电解足量硫酸铜溶液一段时间加入氧化铜固体可使电解质恢复到电解前 | |
| D. | 惰性电极电解淀粉碘化钾溶液,可看到阴极区域溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
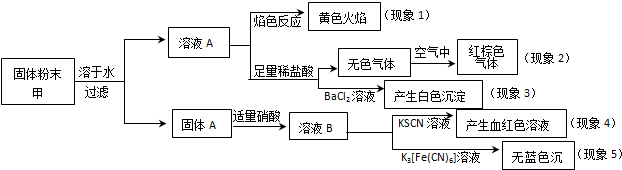
| A. | 根据现象1可推出该固体粉末中含有钠元素,但一定不含钾元素 | |
| B. | 根据现象2可推出该固体粉末中一定不含有NaNO2 | |
| C. | 根据现象3可推出该固体粉末中一定含有Na2SO4 | |
| D. | 根据现象4和现象5可推出该固体粉末中一定不含FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LNO2分子总数小于0.1NA | |
| B. | 50ml,18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com