
 �ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����
�ḻ��CO2��ȫ������Ϊ��̼Դ�������ǰӦ����㷺��̼Դ��ʯ�ͺ���Ȼ��������������Ҷ���ݽߵ�Σ����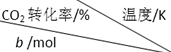 | 500 | 600 | 700 | 800 |
| 1.67 | X | 33 | ||
| 1.25 | 60 | 43 | Y | |
| 0.83 | Z | 32w |
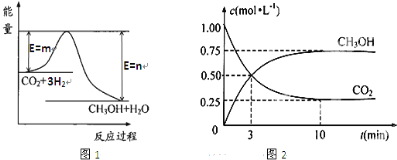
���� ��1����ѹ�����г���1mol CO2��3mol H2��ת���ʴ�50%ʱ�ų�����19.6KJ����1molCO2��ȫת������Ϊ39.2 kJ���ݴ���д�Ȼ�ѧ����ʽ��
��2����Ӧ���ʼӿ죬�������»���ʹ�ô�������ʹ��Ӧ���ʼӿ������
��3���������¶�CO2��ת���ʼ�С����������Ϊ���ȷ�Ӧ��
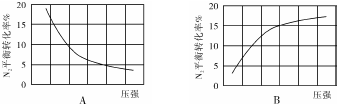
��CO2��ʼ���ʵ���Ϊ1.25molʱ���¶�Խ�ߣ�CO2��ת����ԽС����w��32��x��33������CO2��g����H2��g�������ʵ���1��3��Ӧ�������߰����ʵ���1��3���ʱ����a=0.83������ת������ȣ���800KʱCO2��H2��ת���ʾ�Ϊw%��CO2��g������ʼ���ʵ���Խ����ת����ԽС����y��w��
�������¶����淽���ƶ����¶�Խ�ߣ�ƽ�ⳣ��ԽС��
��� �⣺��1����ѹ�����г���1mol CO2��3mol H2��ת���ʴ�50%ʱ�ų�����19.6KJ����1molCO2��ȫת������Ϊ39.2 kJ����Ӧ���Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-39.2 kJ•mol-1��
�ʴ�Ϊ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-39.2 kJ•mol-1��
��2��t min��2t minʱ���ʣ���Ӧ���ʼӿ죬������2tʱ�̣���ƽ��״̬�����������»�ʹ���˴�����
�ʴ�Ϊ�����»�ʹ���˴�����
��3���������¶�CO2��ת���ʼ�С����������Ϊ���ȷ�Ӧ�����Խ���ʱ��ƽ��������Ӧ�����ƶ���
�ʴ�Ϊ������Ӧ��
��CO2��ʼ���ʵ���Ϊ1.25molʱ���¶�Խ�ߣ�CO2��ת����ԽС����w��32��x��33������CO2��g����H2��g�������ʵ���1��3��Ӧ�������߰����ʵ���1��3���ʱ����a=0.83������ת������ȣ���800KʱCO2��H2��ת���ʾ�Ϊw%��CO2��g������ʼ���ʵ���Խ����ת����ԽС����y��w��������������֪x��y��
�ʴ�Ϊ��B��
�������¶����淽���ƶ����¶�Խ�ߣ�ƽ�ⳣ��ԽС������ƽ�ⳣ����ϵΪ��Kx��Kz��Ky=Kw��
�ʴ�Ϊ��Kx��Kz��Ky=Kw��
���� ���⿼�黯ѧƽ����㡢��ѧƽ��Ӱ�����ء���Ӧ�ȼ���ȣ���Ŀ�Ѷ��еȣ���Ŀ�ϺõĿ���ѧ������������֪ʶǨ��������������3����ת���ʱȽ�Ϊ�״��㡢�Ѷȣ�ò�����Ƚϣ��ؼ��Ǹ��ݶ���ת������������Է������


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д� һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
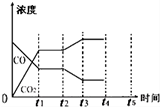
| ��Ӧʱ��/min | n��CO��/mol | n ��H2O��/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
| ��� | �Ȼ�ѧ����ʽ |
| �� | CO��g��+2H2��g��?CH3OH��g����H1=-99kJ•mol-1 |
| �� | 2CH3OH��g��?CH3OCH3��g��+H2O��g����H2=-24kJ•mol-1 |
| �� | CO��g��+H2O��g��?CO2��g��+H2��g����H3=-41kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 2013��12��17�գ��й�������Դ���ٿ����ŷ����ᣬ�����ڹ㶫�غ��齭����ض��������״����ߴ��ȿ�ȼ������ȼ������Ҫ�ɷ��Ǽ��飬�����������ȼ�ϣ�Ҳ����Ҫ�Ļ���ԭ�ϣ�
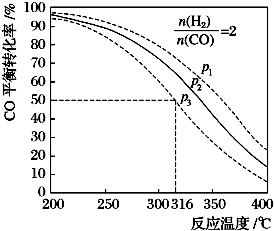
2013��12��17�գ��й�������Դ���ٿ����ŷ����ᣬ�����ڹ㶫�غ��齭����ض��������״����ߴ��ȿ�ȼ������ȼ������Ҫ�ɷ��Ǽ��飬�����������ȼ�ϣ�Ҳ����Ҫ�Ļ���ԭ�ϣ�| ���� | H2 | CO | CH3OH |
| Ũ��/��mol•L-1�� | 0.20 | 0.10 | 0.40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | �¶� | N2��ʼ��/mol | N2�����ʵ���/mol | ||||||
| 5��s�� | 10��s�� | 15��s�� | 20��s�� | 25��s�� | 30��s�� | 35��s�� | |||
| �� | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
| �� | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
| �� | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
| �� | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ħ������g/mol | B�� | ����Ħ�����L/mol | ||
| C�� | �ܽ��g/100g | D�� | ���ʵ���Ũ��mol/L |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com