
| 检测次数 | 溶液中检测出的溶质 |
| 第一次 | KCl、K2SO4、Na2CO4 |
| 第二次 | BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3 |
| 实验步骤 | 实验操作 | 实验目的 | 离子反应 |
| 第一步 | 向溶液中滴加过量的HNO3溶液 | 检验 |
|
| 第二步 | 继续滴加过量的Ba(NO3)2溶液 | 检验SO42-的存在 | |
| 第三步 | 过滤,再向滤液中滴加 |
检验 |
Ag++Cl-=AgCl↓ |
| 实验步骤 | 实验操作 | 实验目的 | 离子反应 |
| 第一步 | CO32- | 2H++CO32-=CO2↑+H2O | |
| 第二步 | SO42- | SO42-+Ba2+=BaSO4↓ | |
| 第三步 | 硝酸银 | Cl- |


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
| A、使用催化剂一定能加快反应速率 |
| B、用粉末状锌代替块状锌与稀硫酸反应一定会加快反应速率 |
| C、当反应物与生成物浓度相等时,可逆反应一定已达到化学平衡状态 |
| D、在合成氨反应中,增大N2浓度一定可以使H2的转化率达到100% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.写出FeCl3溶液腐蚀印刷电路铜板的离子方程式;
(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.写出FeCl3溶液腐蚀印刷电路铜板的离子方程式;| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
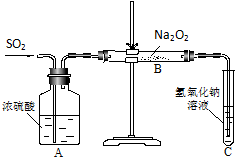 有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C,木条复燃.请回答下列问题:
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C,木条复燃.请回答下列问题: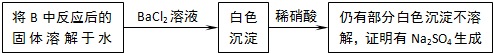
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
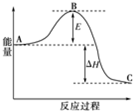 合成氨反应N2(g)+3H2(g)=2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.
合成氨反应N2(g)+3H2(g)=2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.查看答案和解析>>
科目:高中化学 来源: 题型:
| 结构简式 | 系统命名法命名 | |
| 可能1 | ||
| 可能2 | ||
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com