
【题目】常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如表所示:
序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 13 |
② | 22.00 | 18.00 | 12 |
③ | 22.00 | 22.00 | 7 |
(1)Ba(OH)2溶液的物质的量浓度为?
(2)x的值是多少?
(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时溶液的pH为多少?(已知lg2=0.3)
【答案】
(1)解:根据①知,Ba(OH)2溶液中未加稀盐酸时,溶液的pH=13,则溶液中c(OH﹣)= ![]() mol/L=0.1mol/L,根据OH﹣守恒计算c[Ba(OH)2]=
mol/L=0.1mol/L,根据OH﹣守恒计算c[Ba(OH)2]= ![]() ×c(OH﹣)=
×c(OH﹣)= ![]() ×0.1mol/L=0.05mol/L,
×0.1mol/L=0.05mol/L,
答:氢氧化钡物质的量浓度为0.05mol/L;
(2)解:根据③知,相同体积的氢氧化钡和稀盐酸混合时,混合溶液呈中性,说明酸中n(H+)等于碱中n(OH﹣),因为体积相同,所以酸中c(H+)等于碱中c(OH﹣)为0.1mol/L,所以x=1,答:x值为1;
(3)解:向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时,Ba(OH)2、NaHCO3的物质的量之比为1:1,二者反应生成碳酸钡沉淀、水和NaOH,设碳酸氢钠的体积为xL,则0.05mol/L×0.1L=0.05mol/L×xL,x=0.1,混合溶液中n(NaOH)=n(NaHCO3)=0.05mol/L×0.1L=0.005mol,c(NaOH)= ![]() =0.025mol/L,溶液中c(H+)=
=0.025mol/L,溶液中c(H+)= ![]() mol/L=4×10﹣13 mol/L,溶液的pH=﹣lgc(H+)=﹣lg4×10﹣13=12.4,
mol/L=4×10﹣13 mol/L,溶液的pH=﹣lgc(H+)=﹣lg4×10﹣13=12.4,
答:混合溶液的pH为12.4.
【解析】(1)根据①知,Ba(OH)2溶液中未加稀盐酸时,溶液的pH=13,则溶液中c(OH﹣)= ![]() mol/L=0.1mol/L,根据OH﹣守恒计算c[Ba(OH)2];(2)根据③知,相同体积的氢氧化钡和稀盐酸混合时,混合溶液呈中性,说明酸中n(H+)等于碱中n(OH﹣),因为体积相同,所以酸中c(H+)等于碱中c(OH﹣);(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时,Ba(OH)2、NaHCO3的物质的量之比为1:1,二者反应生成碳酸钡沉淀、水和NaOH,n(NaOH)=n(NaHCO3),再计算c(NaOH)及溶液的pH.
mol/L=0.1mol/L,根据OH﹣守恒计算c[Ba(OH)2];(2)根据③知,相同体积的氢氧化钡和稀盐酸混合时,混合溶液呈中性,说明酸中n(H+)等于碱中n(OH﹣),因为体积相同,所以酸中c(H+)等于碱中c(OH﹣);(3)向100mL上述Ba(OH)2溶液中逐滴加入0.05mol/L NaHCO3溶液,当沉淀刚好达最大值时,Ba(OH)2、NaHCO3的物质的量之比为1:1,二者反应生成碳酸钡沉淀、水和NaOH,n(NaOH)=n(NaHCO3),再计算c(NaOH)及溶液的pH.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】已知几种阴离子还原性强弱顺序为F-<Cl-<Br-<I-<S2-。某溶液含有相同浓度的F-、Cl-、Br-、I-、S2-,当向其中逐滴加入新制的饱和氯水直至过量时,最后被氧化的离子是 ( )
A.Br-B.Cl-C.F-D.S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题:
(一)制取氨气
(1)写出实验制取氨气的化学方程式;
(2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的?(填“能”或“否”),理由是。
(3)(二)该小组中某同学设计了如下实验装置(夹持及尾气入理装置未画出),探究氨气的还原性: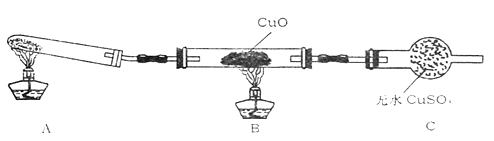
该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是。
(4)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中 ![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mLpH=11的NaOH溶液,混合液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.100molL﹣1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写) .
(2)上述B步骤操作的目的是 .
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果(填“偏高“、“偏低”或“不变”).
(4)判断到达滴定终点的实验现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题。 Ⅰ.H2S的除去
方法1:生物脱H2S的原理为:
H2S+Fe2(SO4)3![]() S↓+2FeSO4+H2SO4
S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是。
(2)由图3和图4判断使用硫杆菌的最佳条件为。若反应温度过高,反应速率下降,其原因是。 
(3)方法2:在一定条件下,用H2O2氧化H2S 随着参加反应的n(H2O2)/n(H2S)变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物的分子式为。
(4)Ⅱ.SO2的除去 方法1(双碱法):用NaOH吸收SO2 , 并用CaO使NaOH再生
NaOH溶液 ![]() Na2SO3
Na2SO3
写出过程①的离子方程式:;CaO在水中存在如下转化:
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s) ![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
从平衡移动的角度,简述过程②NaOH再生的原理。
(5)方法2:用氨水除去SO2已知25℃,NH3·H2O的Kb=1.8×105 , H2SO3的Ka1=1.3×102 , Ka2=6.2×108。若氨水的浓度为2.0 mol·L-1 , 溶液中的c(OH)=mol·L1。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c( ![]() )/c(
)/c( ![]() )=。
)=。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分) 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:、。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。 
①仪器B的名称是。
②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2 , 缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示)。若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2 , 缓缓通入N2 , 加热。实验后反应管中残留固体为红色粉末。 
①C、D中的溶液依次为(填标号)。C、D中有气泡冒出,并可观察到的现象分别为。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | -69 | -25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:。
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH0(填“>”“<”或“=”),判断依据:。
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是。
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
物质a是 , T2应控制在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空
(1)含0.6mol Al2(SO4)3中,Al3+的个数为 , 在标准状况下的11.2L氮气,含有氮原子的数目为 , 某金属氯化物MCl281g,含有1.20molCl﹣ , 则该氯化物的摩尔质量为 .
(2)4mol的NH3和mol的H2S含有相同的氢原子,相同质量的C02和CO所含氧原子的物质的量之比为 , 所含氧原子数相同的C02和CO的物质的量之比为 , 标准状况下体积比为 .
(3)现有:①汽油和氯化钠溶液 ②39%的酒精溶液,分离以上混合液的正确方法依次是、(填“过滤”;“分液”;“结晶”;“蒸馏”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com