
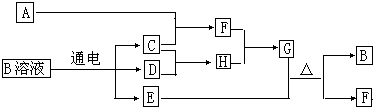
 如图的转化关系中,A、C、D是常见的气体单质,D气体在常温下呈黄绿色.F气体极易溶于水,且液态常作制冷剂,B的焰色反应为黄色.图中的部分反应产物或反应物已略去.
如图的转化关系中,A、C、D是常见的气体单质,D气体在常温下呈黄绿色.F气体极易溶于水,且液态常作制冷剂,B的焰色反应为黄色.图中的部分反应产物或反应物已略去.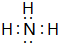 ,故答案为:
,故答案为: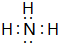 ;
;
| ||
| ||


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
| A、生成物的质量分数一定增加 |
| B、生成物的物质的量一定增加 |
| C、反应物的转化率一定增加 |
| D、反应物的浓度不一定降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
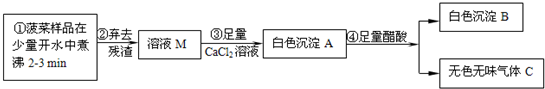
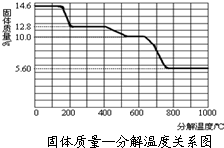
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
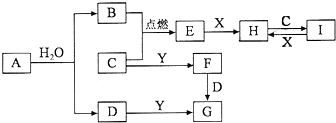 有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.
有关物质的转化关系如图所示(部分物质和条件已略去).B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:
 一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报告.
一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe3++Cu═2Fe2++Cu2+).请按要求完成下列探究报告.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com