
分析 (1)氧化还原反应中化合价升高值=化合价降低值=转移电子数,根据电子守恒来配平方程式;
(2)根据氮元素的化合价变化为+5→+2,结合得失电子守恒和氮原子守恒解答.
解答 解:(1)该反应中铁元素的化合价变化为0→+2,所以一个铁原子失去2个电子,氮元素的化合价变化为+5→+2,所以一个参加氧化还原反应的硝酸根离子得到3个电子,所以得失的最小公倍数是6,所以铁的计量数是3,NO的计量数是2,其它元素根据原子守恒进行配平,所以该方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,
故答案为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;
(2)标准状况下,当生成2.24L NO气体时,其物质的量为0.1mol,转移0.2mol×(5-2)=0.3mol电子,氮元素的化合价变化为+5→+2,由N原子守恒可知,0.1mol氧化剂被还原,故答案为:0.3;0.1.
点评 本题考查了氧化还原反应等知识点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应的配平、氧化还原反应基本概念和转移电子的考查,题目难度不大.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐的组成中一定含有金属元素 | |
| B. | 金属一定能与酸反应产生氢气 | |
| C. | 由同种元素组成的纯净物一定是单质 | |
| D. | 同一化合物里同种元素的化合价一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T/℃ | NO初始浓度 ( mol•L-1) | CO初始浓度 ( mol•L-1) | 催化剂的比表面积 ( m2•g-1) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钱恩 | B. | 屠呦呦 | C. | 弗莱明 | D. | 莫言 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5min时容器内气体总的物质的量为3mol | |
| B. | 5min时,容器内D的浓度为0.2mol•L-1 | |
| C. | 该可逆反应随反应的进行,容器内压强逐渐增大 | |
| D. | 在5min内该反应用C的浓度变化表示的反应速率为0.02mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②⑤ | C. | ①②③⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
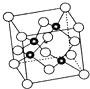 砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题:
砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com