
有0.1 mol·L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
A.溶液①中,c(CH3COO-)= c(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- )
C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+)
D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-)
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
蓓萨罗丁是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,有研究者设计其合成路线如下(部分反应试剂和条件已略):
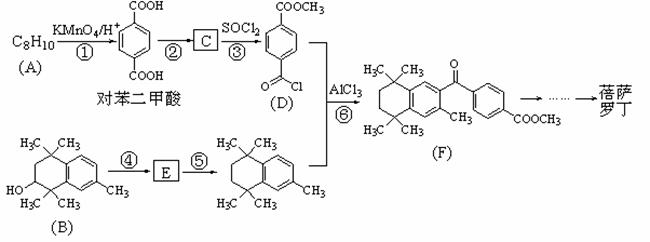
已知:Ⅰ.  Ⅱ.
Ⅱ.
试回答下列问题:
(1) D的分子式为 ; F分子中含氧官能团的名称为 、 。
(2)原料A的结构简式为 ;原料B发生反应④所需的条件为 。
(3)反应①、⑥所属的反应类型分别为 、 。
(4)反应②、⑤的化学方程式分别为②______________;⑤ ______________。
(5)对苯二甲酸有多种同分异构体,符合下列条件的同分异构体有 种,写出其中任意一种的结构简式 。
①苯环上有三个取代基;②能与NaHCO3溶液发生反应;③能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关结论中,正确的是
A.浓度为0.lmol/LCuSO4溶液,温度升高,溶液的pH降低
B.—元酸与—元碱恰好完全反应后的溶液中—定存在c(H+)=c(OH-)
C.浓度相同的AlCl3、NH3 H2O、Ba(OH2)三物质的溶液,等体积混合时没有沉淀生成
H2O、Ba(OH2)三物质的溶液,等体积混合时没有沉淀生成
D.在所有能够溶解Al(OH)3的溶液中Cu2+、ClO-、Cl-、 Ca2+一定能够大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2L的密闭容器中,X、 Y、Z三种气体的物质的量随时间变化的曲线如下图所示:

下列描述正确的是
A.反应开始到10s,用Z表示的反应速率为0.158 mol/(L·s)-1
B.反应开始到l0s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10S时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g) Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数由小到大排列的四种短周期元素X、Y、 Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。 M元素与X同主族,与W同周期。
(1)M元素是__________(填元素符号)。
(2)Z、W形成的气态氢物的稳定性为_______>________。(填化学式)
(3)写出M2Z2的电子式_________,写出M2Z2与水反应的离子方程式__________。
(4)由X、Y、Z、W四种元素中的三种组成的—种强酸,该强酸的稀溶液能与铜反应,离子方程式为
__________________________________。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是__________
(填化学式).写出该气体B与氯水反应的离子方程式__________________________________________。(6)由X、Y、 Z、W和Fe五种元素组成的相对分子质量为392的化合物C,1mol C中含有6mol结晶水。对化合物C进行下实验:
a.取C的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取C的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①写出C的化学式为_______________________________________。
②试写出C与M2Z2按物质的量比1:2在溶液中反应的化学方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是人类生产和生活中必不可少的重要金属。
 (1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___________。
(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___________。
计算铁元素的近似相对质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%、a2%……是指各同位素的____________________。
(2)铁原子中有______种能量不同的电子,铁原子次外层的电子云有_____种不同的伸展方向。
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为________________________________。
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于_________极,电解质溶液是____________________。
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:
___Fe(NO3)3 + ___NaOH + ___Cl2 →___Na2FeO4 + ___NaNO3 + ___NaCl + ___H2O
高铁酸钠除了能消毒杀菌外,还能吸附水中的悬浮物,其原因是______________________。
(6)0.03mol的铁加到过量的HNO3中,加热,铁完全溶解,若生成NO、NO2的混和气体共1.12L(标准状况)。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D和E,5种分子含原子的数目依次为1、2、3、4和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成。
请回答下列问题:
(1)B和C的分子式分别是 和 。
(2)若向D的稀溶液中加入少量二氧化锰,有无色气体生成,则D的分子式是 。
(3)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2mol H2O,则E的分子式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学----选修结构化学】(15分)A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题。
(1)A和D的氢化物中,沸点较低的是________(填化学式);该物质固态时属于________晶体;
A和D的电负性较大的是________(填元素符号);
B和C的第一电离能较小的是________(填元素符号);
A和B的离子中,半径较小的是________(填离子符号);
构成C单质晶体的微粒以________键相结合。
(2)写出B、C的最高价氧化物的水化物相互反应的离子方程式:____________________。
(3)A和E可组成离子化合物,其晶胞结构如图所示:

阳离子(用“●”表示)位于大立方体的顶点或面心;阴离子(用“○”表示)均位于小立方体的中心。与一个“○”距离最近的“●”有________个,与一个“●”距离最近的“●”有________个,该化合物的化学式是________。
(4)已知晶胞的 的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算,结果保留一位小数。
的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算,结果保留一位小数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com