
【题目】常温下,将0.02mol/LMOH溶液逐滴滴入100mL0.01mol/LHA溶液中,溶液pH随滴入MOH溶液的体积变化如图所示。若忽略溶液混合时的体积变化,下列叙述正确的是( )
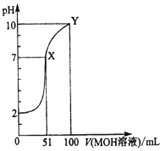
A.温度不变,滴入MOH溶液的过程中水的电离程度不变
B.X点MOH过量,故溶液中c(M+)>c(A-)
C.HA为弱酸,MOH为强碱
D.Y点的c(MOH)+c(M+)=0.01mol/L
【答案】D
【解析】
A.温度不变,将0.02mol/LMOH溶液逐滴滴入100mL0.01mol/LHA溶液中,溶液中酸电离的c(H+)减小,对水的电离的抑制作用减弱,水的电离程度增大,当恰好完全反应生成MA后,随着c(MOH)的增加,水的电离程度减小,A错误;
B.X点pH=7,溶液呈中性,c(M+)=c(A-),B错误;
C.根据图象可知,加入MOH溶液前,0.01molL-1HA溶液的pH=2,说明HA在溶液中完全电离,则HA是强酸;X点MOH的物质的量大于HA的物质的量,此时溶液呈中性,说明MOH是弱碱,C错误;
D.Y点时,滴入100mL 0.02mol/LMOH溶液,此时混合溶液的总体积是200mL,故c(MOH)+c(M+)=0.01mol/L,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和N2一定条件下能直接生成氨:3CH4(g)+2N2(g)![]() 3C(s)+4NH3(g)-Q,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如所示。正确的是
3C(s)+4NH3(g)-Q,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如所示。正确的是
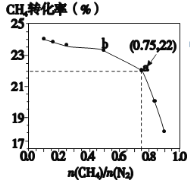
A.n(CH4)/n(N2)越大,CH4的转化率越高
B.n(CH4)/n(N2)不变时,升温,NH3的体积分数会增大
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为13%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.石灰水中加入过量小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
B.用石墨作电极电解AlCl3溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D.0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AG=lg![]() ,电离度α=
,电离度α=![]() ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
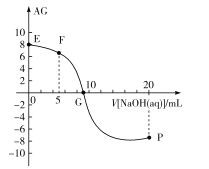
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
查看答案和解析>>
科目:高中化学 来源: 题型:
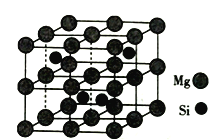
【题目】镁、硅及其化合物用途非常广泛。回答下列问题:
(1)基态Si原子价层电子的电子排布式为___,基态Mg原子电子占据最高能级的能层符号___。
(2)Mg2C3与CaC2的结构相似,与水反应可生成H2C=C=CH2,H2C=C=CH2端位碳原子的杂化方式是__,该反应所涉及的元素中电负性最小的是__(填元素符号),Mg2C3和H2C=C=CH2中均不存在___(填字母)。
A.σ键 B.配位键 C.氢键 D.π键
(3)晶格能又叫点阵能。它是1mol离子化合物中的正、负离子从相互分离的气态结合成离子晶体时所放出的能量。MgO晶格能可通过图1的BornHaber循环计算得到。
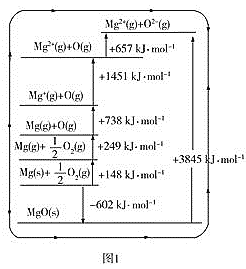
MgO的晶格能为___kJ·mol-1,O=O键的键能为__kJ·mol-1;Mg的第一电离能为___kJ·mol-1;
(4)Mg2Si晶胞结构如图2所示,已知其密度为1.84g·cm3,NA为阿伏加德罗常数的值。则晶胞参数a=__nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
随着社会经济的发展,汽车已进入千家万户,它给人们出行带来方便的同时汽车尾气污染问题也日益突显,汽车尾气中含NO、NO2、CO2、SO2和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:C(s)+2NO(g) ![]() N2(g)+CO2(g),可实现氮氧化物无害转化。
N2(g)+CO2(g),可实现氮氧化物无害转化。
【1】下列环境问题与汽车尾气的大量排放无关的是
A.酸雨B.温室效应C.PM2.5超标D.白色污染
【2】该反应属于化学基本反应类型中的
A.化合反应B.分解反应C.置换反应D.复分解反应
【3】该反应属于氧化还原反应,下列说法正确是
A.C元素被还原B.NO得到电子C.NO发生氧化反应D.CO2是氧化剂
【4】关于该反应下列说法不正确的是
A.升高温度能够加快反应速率
B.降低NO浓度能够减慢反应速率
C.使用合适的催化剂可以加快反应速率
D.加入足量的炭粉可以使NO 100%转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组的同学在学习NH3的性质时讨论:既然NH3具有还原性,能否像H2那样还原CuO呢?于是他们设计了如下实验装置(夹持装置未画出)进行实验。

请回答下列问题:
(1)仪器a的名称为______________;仪器b中可选择的试剂为______________;
(2)实验中观察到装置C中黑色CuO粉末变为红色固体,干燥管D增重,量气管内收集到无色无味的单质气体,上述现象可以证明NH3具有________性,写出相应的化学方程式_____________;
(3)E装置中浓硫酸的作用是________________________________
(4)读取气体体积前,应对装置F进行的操作是:________________________若读数时,量气管中的液面低于水准管的液面,则量气管中气体的体积将_____。(填“偏大”、“偏小”或“不变”)。
(5)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物,在酸性溶液中,Cu+易发生自身的氧化还原反应(2Cu+→Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O:_______________________________。
(6)此套实验装置还可用于测定氨气的分子组成。若实验完毕,测得干燥管D增重m克,装置F测得气体的体积为n升(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s)![]() KCl(l)+NaAlSi3O8(s) △H=-Q kJ/mol。
KCl(l)+NaAlSi3O8(s) △H=-Q kJ/mol。
(1)写出Cl原子的核外电子排布式_______, NaCl的熔点比KCl______ (选填“高”或“低”)。
(2)指出钾长石中存在的化学键类型__________________。
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,该元素是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com