
����Ŀ�������£���������(NaUr)����Һ���ã�ȡ�ϲ���Һ����ͨ��HCl����Һ�������Ũ��c(NaUr)��pH�Ĺ�ϵ��ͼ��ʾ����֪��Ksp(NaUr)=4.9��10-5��Ka(HUr)=2.0��10-6������˵����ȷ����![]()
![]()
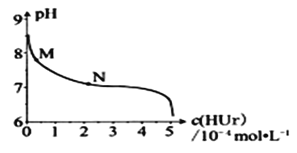
A.�ϲ���Һ�У�c(Ur-)=7.0��10-2molL-1
B.��M��N�ı仯�����У�c(Na+)c(Ur-)��ֵ���ֲ���
C.��c(NaUr)= c(Ur-)ʱ��c(Cl-)>c(Ur-)
D.��pH=7ʱ��2c(Na+)=c(Ur-)+c(Cl-)
���𰸡�C
��������
A.����Ksp(NaUr)= c(Na+)c(Ur-)=4.9��10-5�����c(Ur-)��
B.��M��N�ı仯�����У�ͨ���Ȼ��⣬c(Na+)���䣬c(Ur-)��С��
C.���ݵ���غ�������غ���з����жϣ�
D.��pH=7ʱ����Һ�����ԣ����ݵ���غ���з����жϡ�
A.����Ksp(NaUr)= c(Na+)c(Ur-)=4.9��10-5�����c(Ur-)=![]() =7.0��10-3mol/L��A�����
=7.0��10-3mol/L��A�����
B.��M��N�ı仯�����У�ͨ���Ȼ��⣬c(Na+)���䣬c(Ur-)��С����c(Na+)c(Ur-)��ֵ��С��B�����
C.���ݵ���غ��У�c(Na+)+c(H+)=c(Cl-)+c(Ur-)+c(OH-)�����������غ��У�c(Na+)= c(Ur-)+c(HUr)֪c(HUr)+c(H+)=c(Cl-)+c(OH-)����c(Ur-)=c(HUr)������c(Ur-)+c(H+)=c(Cl-)+c(OH-)����c(Ur-)=c(HUr)ʱ������Ka(HUr)=2.0��10-6��c(H+)=2.0��10-6mol/L>c(OH-)=![]() �����c(Cl-)>c(Ur-)��C����ȷ��
�����c(Cl-)>c(Ur-)��C����ȷ��
D.��pH=7ʱ����Һ�����ԣ����ݵ���غ��c(Na+)=c(Ur-)+c(Cl-)��D�����
��ѡC��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ϢϢ��أ�����������ʳƷ��ȫԽ��Խ�ܵ����ǵĹ�ע��
(1)�����������������������ͬ�ĺ������Իش��������⣺
��Ϊȷ���������������ʴﵽ95������ ����������״������У�����Ҫ����ָ������________��
A�������������(pm2.5�� B��NO2 Ũ�� C��SO2Ũ�� D��CO2Ũ��
����ɳ�����ն�����Ҫ������_____________________��
����ɫ����������֮һ�Ƕ�����̼���ŷš�Ϊ����Ӧ��̼����ι���������� __________(A����˽�ҳ� B���˹�����)������ͣ��������װ������β���������ʩ�� д������β����CO��NO��������ɿɲ������ѭ������������Ļ�ѧ����ʽ��
____________________________________________________________________��
(2)��������ˮƽ����ߣ�����Խ��Խ��ע�����Ľ�����������̽�ֻ�ѧ���������彡�� ���й����⣺��Ԫ�������彡��������أ�����ʳ�ṹ������������ij����Ԫ�ز� �㣬�ͻ�����ijЩ�����������״���״�(�׳ƴ��Ӳ�)������������ȱ_________��������Ԫ��������������ܻᵼ��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�У���������ˮ�������ɵ�H+Ũ��֮��(�٣��ڣ��ۣ���)��(����)
��pH=0������ ��0.1molL��1������ ��0.01molL��1��NaOH��Һ��pH=11��NaOH��Һ��
A.1��10��100��1 000B.0��1��12��11
C.14��13��12��11D.14��13��2��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ���仯�����ڹ�ũҵ������Ӧ�ù㷺��
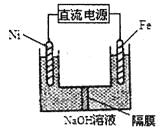
��1���ڳ�ʪ�����У����������绯ѧ��ʴת��ΪFe(OH)2�ķ�Ӧ����ʽΪ_______���ں��е�Ũ��������Һ������װ���У�����ʴ�������ɿ쵽����˳����____________���������д����

��2����֪����3Fe��s��+2O2��g��=Fe3O4��s��![]() H=-1118 kJ��mol-1
H=-1118 kJ��mol-1
��2Al��s��+3/2O2��g��=A12O3��s��![]() H=-1675.7 kJ��mol-1
H=-1675.7 kJ��mol-1
�Ӹֹ�ʱ����Fe3O4������Ӧ��������Al2O3���Ȼ�ѧ����ʽΪ______________��
��3��Na2FeO4����ǿ�����ԣ������Ʒ���ͼ��ʾ����д�������ĵ缫��Ӧʽ______��Na2FeO4��һ�ּ���ɱ��������������������ˮ��ˮ����������ԭ����______________��
��4����ҵ�ϳ���FeCl3��Һ��ʴӡˢ��·�壬������Ӧ�����ӷ���ʽ��____________������ʴͭ������Һ�У�Cu2+��Fe3+��Fe2+Ũ�Ⱦ�Ϊ0��1 mol��L-1�������ͼ�������������Һ��ͨ�백��������Һ��pH=5��6ʱ����Һ�д��ڵĽ���������Ϊ____����ͼ�����ݼ���Fe(OH)2���ܶȻ�Ksp[Fe(OH)2]=______��
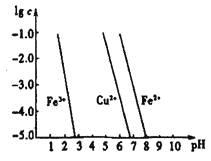
��֪��������Ϊ��Һ��pH��������Ϊ�������ӵ����ʵ���Ũ�ȵĶ���������Һ�н�������Ũ��![]() 10-5mol��L-1ʱ������Ϊ������ȫ����
10-5mol��L-1ʱ������Ϊ������ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ƽ����ϵ�ĸ�˵���в���ȷ����(����)
A.��N2+3H2![]() 2NH3��ƽ����ϵ�У���С�����ƽ�������ƶ������IJ�������
2NH3��ƽ����ϵ�У���С�����ƽ�������ƶ������IJ�������
B.��CH3COOH ![]() CH3COO��+H+��ƽ����ϵ�м���CH3COONa���壬ƽ�������ƶ�
CH3COO��+H+��ƽ����ϵ�м���CH3COONa���壬ƽ�������ƶ�
C.��ˮ���µ�100��ʱ��pHС��7��������
D.�������м���KCl���壬��ҺpH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶������ݻ�Ϊ2 L���ܱ������ڽ���ijһ��Ӧ������������X������Y�����ʵ����淴Ӧʱ��仯��������ͼ��ʾ����ͼ��֪
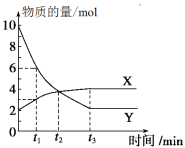
A. ��Ӧ�Ļ�ѧ����ʽΪ4Y=X
B. ��Ӧ���е�t1ʱ��Y��Ũ�ȼ�����3 mol��L��1
C. ��Ӧ���е�t2ʱ���ﵽƽ��״̬
D. ��Ӧ���е�t3ʱ��ÿ����4 mol Y��ͬʱ����1 mol X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Q��R���ֶ���������Ԫ�أ�ԭ��������������Z��̬ԭ�Ӻ���������δ�ɶԵ��ӣ�Y��Z��W�ֱ���X�γɳ���������ķ��ӽṹ����Ϊ���������Ρ������κ�V�Σ�Q�ĸ������������±���W��R��ͬ��Ԫ�ء�
Q | I1 | I2 | I3 | I4 | I5 | �� |
�����ܣ�kJ/mol�� | 496 | 4562 | 6912 | 9543 | 13353 | �� |
�ش������й����⣺
��1��Wԭ�ӵ���Χ�����Ų�ͼΪ____________��
��2��������XYZ���ṹʽ��______��
��3����ͬ�����£�YW2��RW2������ˮ�е��ܽ�Ƚϴ����__________��д����ʽ����ԭ����_________��
��4��RW3�����еļ���_______��RW32-�����幹����_________�Ρ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���к���CO��NO���к����塣
��1������β����NO���ɹ��̵������仯��ͼʾ��1molN2��1molO2��ȫ��Ӧ����NO��____�����������������ų�����____kJ������

��2��ͨ��NO�������ɼ������β����NO�ĺ������乤��ԭ����ͼ��ʾ������ʾ��O2-���ڴ˹��������������ƶ���

��NiO�缫�Ϸ�������___________��Ӧ������������������ԭ������
�����·�У������Ǵ�_________�缫����������NiO������Pt������
��Pt�缫�ϵĵ缫��ӦʽΪ________________________��
��3��һ�����ʹ�������NO��CO�ķ�Ӧ��2NO+2CO![]() 2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
ʵ���� | t���棩 | NO��ʼŨ�� ��mol/L�� | CO��ʼŨ�ȣ�mol/L�� | �����ıȱ������m2/g�� |
�� | 280 | 1.2��10��3 | 5.80��10��3 | 82 |
�� | 280 | 1.2��10��3 | b | 124 |
�� | 350 | a | 5.80��10��3 | 82 |
���뽫�������ݲ���������a ___________��
������֤�¶ȶԻ�ѧ��Ӧ���ʹ��ɵ���ʵ��____________����ʵ����ţ���
��ʵ����ʵ����У�NO�����ʵ���Ũ��c��NO����ʱ��t�ı仯������ͼ��ʾ�����б�ʾʵ����������_______����������������������

��4�����ݻ��̶��ľ��������з�����Ӧ2NO+2CO2CO2+N2������˵���Ѵﵽƽ��״̬����________��������ѡ��
A�������ڻ�������¶Ȳ��ٱ仯 B�������ڵ�����ѹǿ���ֲ���
C��2����(NO)=����(N2) D�������ڻ�������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ������������Ĵ�����ӣ���������������˺ܴ����Ⱦ������β��װ��������ڴ�������������������õĹ�����ͼ��ʾ������˵����ȷ���ǣ� ��
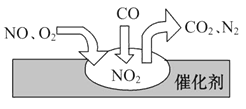
A. ��Ӧ��NOΪ��������N2Ϊ��������
B. ����β������Ҫ��Ⱦ�ɷְ���CO��NO��N2
C. NO��O2�����ڴ���������ܷ�Ӧ
D. ��ת���ܻ�ѧ����ʽΪ2NO��O2��4CO ![]() 4CO2��N2
4CO2��N2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com