
����Ŀ�����ũ�ϩȲ���칹����Ӧ������Name Reactions����¼���÷�Ӧ�ɸ�Ч�ϳ���Ԫ��״����� 
��R1������ԭ�ӻ�������X������ԭ�ӻ�ԭ�ӣ�
ij��Ԫ��״������I�� 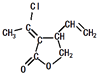 ���ĺϳ�·�����£�
���ĺϳ�·�����£�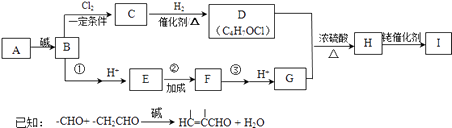
��1�����ĺ���������A����Է�������Ϊ44���˴Ź���������ʾ�����к��������⣬��A������Ϊ ��
��2��A��B�Ļ�ѧ��Ӧ����ʽΪ ��
��3��д��D˳ʽ�ṹ�Ľṹ��ʽ �� B��C�ķ�Ӧ����Ϊ ��
��4��д��H�Ľṹ��ʽ ��
��5���ٵĻ�ѧ�Լ��� ��
��6��д���۵Ļ�ѧ����ʽ ��
��7������˵����ȷ���� �� a��H��I�Ĺ������漰��������˫���������Ķ����Լ�������˫�����γ�
b��C��D��E��F����ʹ������Ȼ�̼��Һ��ɫ
c����F������ͬ�����ŵ�ͬ���칹����8�֣�����F������
���𰸡�
��1����ȩ
��2��2CH3CHO ![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
��3��![]() ��ȡ����Ӧ
��ȡ����Ӧ
��4��CH3C��CCOOCH2CH=CHCH2Cl
��5��������Һ������������ͭ����Һ
��6��![]()
��7��ac
���������⣺���ĺ���������A����Է�������Ϊ44��������ֻ�ܺ���1��Oԭ�ӣ�ʣ��C��Hԭ�������ԭ������Ϊ44��16=28��������к���2��Cԭ�ӡ�4��Hԭ�ӣ��˴Ź���������ʾ�����к��������⣬��AΪCH3CHO�������Ϣ��֪BΪCH3CH=CHCHO����I�Ľṹ��ʽ������ũ�ϩȲ���칹����Ӧ����֪HΪCH3C��CCOOCH2CH=CHCH2Cl����B��������������ȡ����Ӧ����CΪClCH2CH=CHCHO��C�����������ӳɷ�Ӧ����DΪClCH2CH=CHCH2OH����GΪCH3C��CCOOH��E��F���ڼӳɷ�Ӧ����B����������Ӧ���ữ�õ�EΪCH3CH=CHCOOH��B���������������ӳɷ�Ӧ�õ�FΪCH3CHClCHClCOOH��F����±��������ȥ��Ӧ���ữ�õ�G����1��AΪCH3CHO������Ϊ��ȩ�����Դ��ǣ���ȩ����2��A��B�Ļ�ѧ��Ӧ����ʽΪ��2CH3CHO ![]() CH3CH=CHCHO+H2O�����Դ��ǣ�2CH3CHO
CH3CH=CHCHO+H2O�����Դ��ǣ�2CH3CHO ![]() CH3CH=CHCHO+H2O����3��DΪClCH2CH=CHCH2OH��D��˳ʽ�ṹ�Ľṹ��ʽΪ
CH3CH=CHCHO+H2O����3��DΪClCH2CH=CHCH2OH��D��˳ʽ�ṹ�Ľṹ��ʽΪ ![]() ��B��C�ķ�Ӧ����Ϊȡ����Ӧ��
��B��C�ķ�Ӧ����Ϊȡ����Ӧ��
���Դ��ǣ� ![]() ��ȡ����Ӧ����4��������������֪��H�Ľṹ��ʽΪCH3C��CCOOCH2CH=CHCH2Cl��
��ȡ����Ӧ����4��������������֪��H�Ľṹ��ʽΪCH3C��CCOOCH2CH=CHCH2Cl��
���Դ��ǣ�CH3C��CCOOCH2CH=CHCH2Cl����5������ȩ������Ϊ�Ȼ�����ѧ�Լ��ǣ�������Һ������������ͭ����Һ��
���Դ��ǣ�������Һ������������ͭ����Һ����6���۵Ļ�ѧ����ʽΪ�� ![]() ��
��
���Դ��ǣ� ![]() ����7��a��H��I�Ĺ������漰��������˫���������Ķ����Լ�������˫�����γɣ���a��ȷ��
����7��a��H��I�Ĺ������漰��������˫���������Ķ����Լ�������˫�����γɣ���a��ȷ��
b��FΪCH3CHClCHClCOOH������ʹ������Ȼ�̼��Һ��ɫ����b����
c��FΪCH3CHClCHClCOOH����F������ͬ�����ŵ�ͬ���칹�壬���Կ���������Hԭ�ӱ�2����ԭ�ӡ�1����COOHȡ����2����Clȡ��ʱ�����γ�Cl2CHCH2CH3��ClCH2CH2CH2Cl��ClCH2CHClCH3��CH3C��Cl��2CH3 �� �ٱ���COOHȡ���ֱ���3��2��3��1������F�����ʲ���F��ͬ���칹����8�֣���c��ȷ��
��ѡ��ac��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ʱ���ı�ijһ�����Է�ӦA2��g��+3B2��g��2AB3��g���Ļ�ѧƽ��״̬��Ӱ����ͼ��ʾ��T��ʾ�¶ȣ�n��ʾ���ʵ������������ж���ȷ���ǣ� �� 
A.��Ӧ���ʣ�a��b��c
B.�ﵽƽ��ʱA��ת���ʴ�С��b��a��c
C.��T2��T1 �� ������Ӧһ�������ȷ�Ӧ
D.�ﵽƽ��ʱ��n�� AB3���Ĵ�С��b��a��c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽΪ �����ڸ��л����˵������ȷ����(����)
�����ڸ��л����˵������ȷ����(����)
A. 1 mol���л�������2 mol NaOH������Ӧ
B. 1 mol���л�������2 mol Na��Ӧ����1 mol H2
C. 1 mol���л�������1 mol NaHCO3��Ӧ����1 mol CO2
D. 1 mol���л����������4 mol H2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������Ԫ���У�����������������¹������ɵ��ǣ� ��
A.K
B.Ca
C.Na
D.Fe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ������ȷ�����
�� | �� | �� | ���������� | ���������� | |
A | Na2CO3 | H2SO4 | Na2SO4 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO2 |
C | NaHCO3 | CH3COOH | MgCl2 | CuO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | CO |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú��ú��Ʒ����ˮú������̿�����ѵȣ��ѹ㷺Ӧ���ڹ�ũҵ�����У�
��1����֪��C��s��+H2O��g��=CO��g��+H2��g����H=+131.3kJ��mol��l
CO2��g��+H2��g��=CO��g��+H2O��g����H=+41.3kJ��mol��l
��̼��ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽΪ �� �÷�Ӧ��������¡��������¡����κ��¶ȡ����������������Է����У�
��2������̿��ԭ���ɴ������������NO�ȣ��������ķ�ӦΪC��s��+2NO��g��N2��g��+CO2 ��g������ij�ܱ������м���һ�����Ļ���̿��NO����T1��ʱ����ͬʱ���õĸ������Ũ�������ʾ��
ʱ�䣨min�� | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
��10��20min�ڣ�N2��ƽ����Ӧ���ʿ�v��N2��= ��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��е������жϸı������������������ĸ����
A��ͨ��һ������NO B������һ�����Ļ���̿
C��������ʵĴ��� D���ݵ���С���������
��3���о���������ӦCO��g��+H2O��g��H2��g��+CO2��g����ƽ�ⳣ�����¶ȵı仯�����ʾ��
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
����Ӧ��500��ʱ���У�����ʼʱCO��H2O��Ũ�Ⱦ�Ϊ0.020molL��l �� �ڸ������´ﵽƽ��ʱ��CO��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���㶨�¶�ΪT1��ʱ�����ݻ�Ϊ10L���ܱ������г���1.0mol X��0.80mol Y��������Ӧ��
2X��g��+Y��g��2Z��g����X��ת������ʱ��ı仯��ϵ��ͼ��ʾ��
��1����2minʱ�ķ�Ӧ����v1��X��������ڡ�����С�ڡ����ڡ�����8minʱ�ķ�Ӧ���ʿ�v2��X����ԭ���� ��
��2����Ӧ��0��10min��Y��ƽ����Ӧ����v��Y��=molL��1min��l ��
��3��T1���¶��·�Ӧ��ƽ�ⳣ��K1Ϊ �� ���ڵ�10min��ѹ�������ݻ���X��ת���������������С�����䡱����ͬ����ƽ�ⳣ�� ��
��4���������¶ȵ�T2�棨 T2��T1����ƽ��ʱX��ת���ʼ�С����÷�Ӧ�ġ�H0������ڡ���С�ڡ�����
��5�����ı��������ʼ��������£�������θı�������Y��ת����һ��С�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Թ�ҵ������ɰ���÷�����þ��Ϊԭ����ȡMgSO4��7H2O�Ĺ�����ͼ��ʾ�� 
��þ�����Ҫ�ɷ����±���
MgO | SiO2 | FeO��Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
�ش��������⣺
��1������⡱ʱӦ�ü�������� �� ������1������Ҫ������д��ѧʽ����
��2�������ӡ�ʱ���������ơ�����þ�����÷ֱ�������
��3���жϡ����ӡ�������ɵļ��鷽������
��4����������3Ӧ���ȹ��˵�ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ڡ����п��������ձ�����������Ⱦ���ǣ� ��
A.N2
B.SO2
C.CO2
D.CO
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com